
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42— |
B | 先滴加足量稀硝酸,再滴入AgNO3溶液 | 开始无明显现象,后产生白色沉淀 | 原溶液中有Cl- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
A. AB. BC. CD. D
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鑰石(即石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O和木炭粉混合加热至800℃左右可制得与黄金相似的输石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为___________,铜元素基态原子中的未成对电子数为___________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是___________, [Zn(NH3)4]2+中含有的化学键有_______。
②NH3分子中,中心原子的轨道杂化类型为___________, NH3在H2O中的溶解度___________(填“大”或“小”),原因是_________________________________。
(3)铜的第一电离能为I1(Cu)=745.5 kJ·mol-1,第二电离能为l2(Cu)=1957.9 kJ·mol-1,锌的第一电离能为I1(Zn)=906.4 kJ·mol-1,第二电离能为I2(Zn)=1733.3kJ·mo1-1,I2(Cu)>I2(Zn)的原因是_______________

(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为___________;若Cu2O的密度为dg·cm-3,则晶胞参数a=___________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
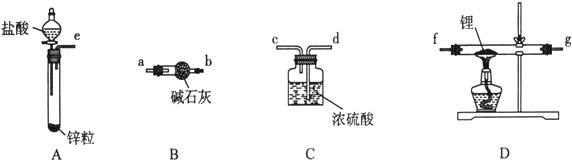
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置按气流从左到右连接顺序为________________,加入药品前首先要进行的实验操作是____________(不必写出具体的操作方法);其中装置B的作用是___________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是____________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,通氢气的作用是___________________________;在加热D处的石英管之前,必须进行的实验操作是__________。
(4)加热一段时间后,停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险,反应方程式为_____________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某结晶水合物的化学式为AnH2O,A的相对分子质量为M,若将ag该化合物加热至结晶水全部失去,剩余的残渣质量为bg,则n=_______
(2)某液态化合物X2Y4,常用作火箭燃料。16gX2Y4在一定量的O2中恰好完全燃烧,反应方程式X2Y4(l)+O2(g)=X2(g)+2Y2O(l))。冷却后测得生成物X2在标准状况下密度为1.25g/L。则
①X2的摩尔质量为_________
②Y2O 是最常见的液态化合物,X2Y4的化学式为__________
③反应前O2的体积(标准状况下)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质都含有钠元素,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可以反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式:
A________B________C________
D________E________F________
(2)写出F和H反应的化学方程式:______。
(3)写出下列反应的离子方程式:D+盐酸_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,水的离子积常数 Kw = 1×10-13,将此温度下 pH = 11 的 Ba(OH)2溶液 a L 与 pH =1的 H2SO4 溶液 b L 混合(设混合溶液体积为两者之和,固体体积忽略不计)。下列说法不正确的是
A. 若 a∶b = 9∶2,则所得溶液 pH 等于 2
B. 若 a∶b = 9∶2,该混合溶液最多能溶解铁粉 0.28(a + b) g
C. 若所得混合溶液为中性,则 a∶b = 1∶1
D. 若所得混合溶液为中性,生成沉淀的物质的量为 0.05b mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1molKClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解分为两步:
①2KClO3+4MnO2![]() 2KCl+2Mn2O7 慢
2KCl+2Mn2O7 慢
②2Mn2O7![]() 4MnO2+3O2 快
4MnO2+3O2 快
下列有关说法不正确的是
A. 1molKClO3所具有的总能量高于1molKCl所具有的总能量
B. 1gKClO3 ,1gMnO2,0.1gMn2O7混合加热,充分反应后MnO2质量仍为1g
C. KClO3分解速率快慢主要取决于反应①
D. 将固体二氧化锰碾碎,可加快KClO3的分解速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com