
A.PH3 B.SiH
解析:判断分子的构型,主要看分子中中心原子是如何成键的。PH3分子中中心原子P的电子排布为1s22s22p63s23p3,形成PH3分子时,采取sp3杂化,得到4个sp3杂化轨道,且有一个杂化轨道上有一对孤对电子,三个杂化轨道上分别有一个未成键电子与氢原子的1s轨道重叠形成三个σ键,由于孤对电子与成键电子对之间的排斥作用,故PH3为三角锥型分子。SiH4分子中的中心原子Si与C同主族,即SiH4和CH4成键类似,故SiH4为正四面体型。BeCl2分子中中心原子Be采取sp杂化,故BeCl2分子为直线形,BCl3分子中中心原子B采取sp2杂化,F、Cl同主族,即BCl3与BF3分子成键类似,故BCl3为平面三角形。
答案:D


科目:高中化学 来源: 题型:
 已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:
已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
 I.已知:
I.已知: ,如果要合成
,如果要合成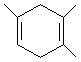 ,所用的原料可以是
,所用的原料可以是

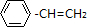
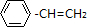


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com