
【题目】在一定温度下,将3molA和2.5molB混合于2L的密闭容器中,发生反应的化学方程式为:3A(气)+B(气)![]() xC(气)+2D(气),5min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速率为0.1mol/(L﹒min),填写下列空白:
xC(气)+2D(气),5min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速率为0.1mol/(L﹒min),填写下列空白:
(1)x=___。
(2)平衡时C的浓度为___。
(3)平衡时B的转化率为___。
【答案】1 0.25molL-1 20%
【解析】
根据三段式解题法,求出混合气体各组分物质的量的变化量、平衡时各组分的物质的量;
(1)达到平衡时,容器内的压强变小,则反应后容器内气体总物质的量减小;
(2)根据物质的量浓度定义计算出c(C);
(3)根据转化率的定义计算。
(1)由题中信息可知,在一定条件下该反应达到平衡时,容器内的压强变小,根据阿伏加德罗定律可知,x+2<3+1,且x为整数,所以x=1;
(2)平衡时,生成的D的物质的量为 0.1mol/(L﹒min)×5min×2L=1mol;

平衡时C的浓度c(C)=![]() =0.25mol/L;
=0.25mol/L;
(3)平衡时B的转化率为![]() ×100%=20%。
×100%=20%。


科目:高中化学 来源: 题型:
【题目】用惰性电极电解AgNO3溶液一段时间后,下列有关说法正确的是( )
A. 阳极质量增加
B. 向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况
C. 电解过程中溶液的pH不断升高
D. 电解后两极产生的气体体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种金黄色易挥发的液体,人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通以氯气即可生成
是一种金黄色易挥发的液体,人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通以氯气即可生成![]() 。有关物质的部分性质如下:
。有关物质的部分性质如下:
物质 | 熔点/ | 沸点/ | 化学性质 |
|
|
| 略 |
|
|
| 遇水生成
|
下图是实验室用![]() 和
和![]() 制备
制备![]() 的装置(夹持装置、加热装置均已略去)。
的装置(夹持装置、加热装置均已略去)。

(1)实验室中制备氯气,可以选用如下________(选填字母)装置。

(2)装置![]() 中应放试剂为___________________;装置
中应放试剂为___________________;装置![]() 的名称是__________________。图中
的名称是__________________。图中![]() 装置中应放置的试剂为______________________,其作用为________________________。
装置中应放置的试剂为______________________,其作用为________________________。
(3)该实验的操作顺序应为_____________________________________(用序号表示)。
①加热装置![]() ②通入
②通入![]() ③通冷凝水 ④停止通
③通冷凝水 ④停止通![]() ⑤停止加热装置
⑤停止加热装置![]()
(4)![]() 粗品中可能混有的杂质是(填写两种)_____________、____________,
粗品中可能混有的杂质是(填写两种)_____________、____________,![]() 粗品可以用___方法(填操作名称)进行提纯。
粗品可以用___方法(填操作名称)进行提纯。
(5)对提纯后的产品进行粗略测定。取![]() 产品,加入
产品,加入![]() 水充分反应(假设
水充分反应(假设![]() 全部逸出),过滤,洗涤沉淀并将洗涤液与滤液合并,用
全部逸出),过滤,洗涤沉淀并将洗涤液与滤液合并,用![]() 容量瓶定容,取
容量瓶定容,取![]() 溶液用浓度为
溶液用浓度为![]() 的硝酸银溶液滴定,三次测定结果如下:
的硝酸银溶液滴定,三次测定结果如下:
1 | 2 | 3 |
|
|
|
则产品中氯元素的质量分数为________(用含有![]() 的式子表示)。若锥形瓶用待测液润洗,对滴定结果的影响是__________(选填“偏大”、“偏小”或“不变”)。
的式子表示)。若锥形瓶用待测液润洗,对滴定结果的影响是__________(选填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )

A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原电池原理和电解原理进行如图回答。
请回答:
I 请根据图作答

(1)如图氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向用a___b(用“→”或“←”表示)。
(2)正极反应式为___________________________。
II 用如图所示装置进行实验(K闭合).

(3)Zn极为________极;实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动。
(4)y极的电极反应现象为________;Cu极的电极反应式为____________________。
(5)若想通过上图实现在铁上镀铜,则应该将y电极换成______(填铁或铜),AlCl3溶液换成___________溶液。
III(6)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HClNH4Cl为电解质溶液制取新型燃料电池,请写出该电池的正极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰及化合物广泛应用于工业生产、制造业等领域。
(1)科研人员将锰粉碎后加入到![]() 溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应
溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应![]() (已知含
(已知含![]() 水溶液为米黄色)
水溶液为米黄色)
①为加快上述反应速率可以采取的措施有________(写出一条即可)。不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
②下列说明反应已达平衡的有_______(填编号)。
A.溶液的颜色不发生变化
B.溶液中![]()
C.体系中固体的质量不变
D.![]() 与
与![]() 浓度的比值保持不变
浓度的比值保持不变
③室温下,测得溶液中阳离子浓度![]() 随时间的变化情况如下图所示,则上述反应的平衡常数K=___,
随时间的变化情况如下图所示,则上述反应的平衡常数K=___,![]() 的转化率为_____。
的转化率为_____。

④若其他条件不变,10mim后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时![]() =_____(不考虑离子水解的影响)。
=_____(不考虑离子水解的影响)。
(2)![]() 也可在
也可在![]() 为体系的电解液中电解获得,其阳极反应式为_____。
为体系的电解液中电解获得,其阳极反应式为_____。
(3)电解制锰后的废水中含有![]() ,常用石灰乳进行一级沉降得到
,常用石灰乳进行一级沉降得到![]() 沉淀,过滤后再向滤液中加入等体积的
沉淀,过滤后再向滤液中加入等体积的![]() 溶液,进行二级沉降,为了将
溶液,进行二级沉降,为了将![]() 的浓度降到
的浓度降到![]() ,则加入的
,则加入的![]() 溶液的浓度至少是___mol/L[已知
溶液的浓度至少是___mol/L[已知![]() ]。
]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期实验目的是()
序号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,A、B两个装置中两个烧杯分别盛有足量的CuSO4溶液:
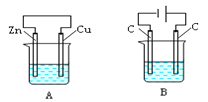
(1)A、B两个装置中属于原电池的是_____(填标号,下同),属于电解池的是____。
(2)A池中Zn是___极,发生______(填氧化或还原)反应,电极反应式为____________; Cu极电极反应式为_______;A中总反应的离子方程式为__________。
(3)B池中左边C是___极,发生______(填氧化或还原)反应,电极反应式____________;右边C极电极反应式为_________;B中总反应的化学方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com