
【题目】如图装置放置一段时间后,铁钉均被腐蚀。下列有关描述不正确的是( )
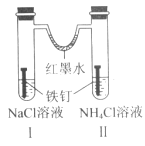
A.红墨水水柱两边的液面变为左低右高
B.I 和Ⅱ中负极反应式均为 Fe-2e-=Fe2+
C.I 中正极反应式为 O2+2H2O+4e-=4OH
D.Ⅱ中 NH4Cl 溶液里有气泡产生
科目:高中化学 来源: 题型:
【题目】I.根据下表所示化学反应与数据关系,回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.50 | 2.15 |
②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.40 | 1.67 |
③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)在973K时,K3=_________。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有______(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO浓度
Ⅱ.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用的氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
(1)电解处理法:
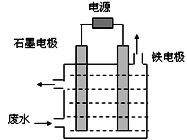
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极” 或“阳极”),阳极产生ClO-的电极反应为__________________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________________________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,
光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
【问题设计】
①请写出HCN的电子式________________。
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为________________(选填编号:![]() .7~10;
.7~10;![]() .10~11;
.10~11;![]() .11~13),解释该pH不宜太大的原因___________________。
.11~13),解释该pH不宜太大的原因___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CCl4 和蒸馏水都是无色液体,请按下列要求用试验方法鉴别两者:
① 只允许用一种试剂:用两支试管分别取出少量的 CCl4和 蒸馏水 ,然后分别加入少量 的单质碘,振荡,呈紫红色的液体 是 _____,呈棕黄色的液体是 _____.
② 不用任何试剂:用试管取少量的其中一种液体,再加入另外一种液体,下层液体是______,上 层液体是_______。
(2)NaCl溶液中含有少量的CaCl2,某学生用过量的 Na2CO3使 Ca2+转化为沉淀而除 去,确认Na2CO3已 过量的实验 方法 是 : _____.
(3) 氢氧化铁胶体的制备方法是 _____。 发生反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
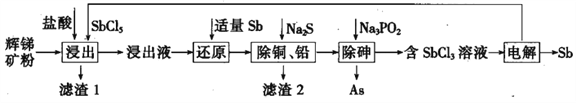
已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________________。
(3)“还原”时,被Sb还原的物质为_____________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______;所加Na2S也不宜过多,其原因为_____________。
(5)“除砷”时有H3PO3生成,该反应的化学方程式为________________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______。
(7)一种突破传统电池设计理念的镁-锑液态金属储能电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,C1-向_____(填“上”或“下”)移动;放电时,正极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素周期表中共有18个纵行,但仅有15个族
C.原子的核外电子层数等于该元素所在的周期数
D.原子最外层电子数等于该元素所在的族序数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡状态的说法中正确的是( )
A. 改变外界条件不能改变化学平衡状态
B. 当某反应在一定条件下反应物转化率保持不变时即达到了化学平衡状态
C. 当某反应体系中气体的压强不再改变时,该反应一定达到平衡状态
D. 当某反应达到平衡状态时,反应物和生成物的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化学的认识中,正确的是()
A. CH3CH=CHCH3分子中的四个碳原子可能在同一直线上
B. 淀粉和纤维素属于多糖, 均可在在人体内水解转化为葡萄糖,为人类提供能量
C. 分子式为 C4H8O且能和金属钠反应的有机物共有三种(不考虑立体异构)
D. 分枝酸结构简式如图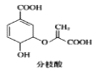 ,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金与铁的物理性质的比较如下表所示:
熔点 | 密度 | 硬度 | 导电性 | |
某合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该合金耐腐蚀,强度大.从以上性能看,该合金不适合用作( )
A.导线
B.门窗框
C.炉具
D.飞机外壳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com