
【题目】某化学兴趣小组用如下实验探究SO2的性质。回答下列问题:
(l)甲同学用废铜屑与浓硫酸为原料制取SO2,发生反应的化学方程式为 ________;SO2是____氧化物,故产生的SO2尾气可用 ____填化学式)溶液吸收。
(2)乙同学向盛有2 mL氯水的试管中通人SO2 一段时间后溶液褪色。SO2 表现出的性质是____,发生反应的离子方程式为____。
(3)丙同学的实验装置如图所示,装置A中SO2和O2的流速比约为____;加热后,玻璃管中的反应方程式为____。

【答案】2H2SO4(浓)+Cu![]() CuSO4+2H2O +SO2↑ 酸性 NaOH(或其它合理答案) 还原性
CuSO4+2H2O +SO2↑ 酸性 NaOH(或其它合理答案) 还原性 ![]() 2:1 2SO2 + O2
2:1 2SO2 + O2![]() 2SO3
2SO3
【解析】
实验室可用浓硫酸与铜共热制SO2;SO2中的S为+4价,不是最高价,有较强的还原性,能被Cl2和O2等氧化性强的物质氧化;SO2是酸性氧化物,能用碱吸收。
(l)铜与浓硫酸加热时能发生反应生成SO2,化学方程式为:2H2SO4(浓)+Cu![]() CuSO4+2H2O +SO2↑;SO2能和碱反应生成盐和水,属于酸性氧化物,故产生的SO2尾气可用NaOH等碱性溶液吸收。答案为:2H2SO4(浓)+Cu
CuSO4+2H2O +SO2↑;SO2能和碱反应生成盐和水,属于酸性氧化物,故产生的SO2尾气可用NaOH等碱性溶液吸收。答案为:2H2SO4(浓)+Cu![]() CuSO4+2H2O +SO2↑;酸性;NaOH(或其它合理答案)
CuSO4+2H2O +SO2↑;酸性;NaOH(或其它合理答案)
(2)SO2使氯水褪色,是因为SO2有较强的还原性,被Cl2氧化成H2SO4,而Cl2被还原成HCl,反应的离子方程式为:![]() 。答案为:还原性;
。答案为:还原性; ![]()
(3)SO2和O2反应生成SO3,需要的条件是:催化剂、加热,是可逆反应,所以方程式为2SO2+ O2![]() 2SO3,根据方程式可知,SO2和O2按2:1反应,所以应控制装置A中SO2和O2的流速比约为2:1。答案为:2:1;2SO2+ O2
2SO3,根据方程式可知,SO2和O2按2:1反应,所以应控制装置A中SO2和O2的流速比约为2:1。答案为:2:1;2SO2+ O2![]() 2SO3
2SO3


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行反应:X2(g)+Y2(g)![]() Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1,0.3mol·L-1,0.2mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1,0.3mol·L-1,0.2mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
A.Z为0.3mol·L-1B.X2为0.3mol·L-1
C.Y2为0.4mol·L-1D.Z为0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mLFe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。下列说法错误的是

A.a点时溶液中金属阳离子有Fe3+、Cu2+和Fe2+
B.b点时溶液中的离子反应有两种
C.原溶液中n(Fe3+):n(Cu2+)=1:1
D.原溶液中Fe2(SO4)3的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,CuSO4·5H2O(s)、CuSO4(s)与其水溶液之间转化的焓变关系如图:
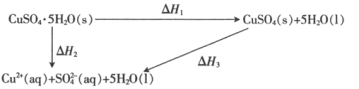
已知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。
下列有关说法正确的是
A.从硫酸铜溶液中析出CuSO4·5H2O(s)的反应焓变△H>0
B.1mol CuSO4(s)的总能量大于1mol Cu2+(aq)与1mol SO42-(aq)的总能量
C.△H2<△H1
D.△H1=△H2+△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)________(填“>”“<”或“=”)v(逆),随后v(正)逐渐______(填“增大”或“减小”,下同),v(逆)逐渐________,反应达到平衡时,V(正)_______(填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则V(N2)=____v'(H2)。
(3)下列措施中不能加快反应速率的是___________(填字母)。
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氦气
(4)写出合成氨反应N2+3H2![]() 2NH3的平衡常数表达式:_____________________________。
2NH3的平衡常数表达式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向体积均为15.0mL,浓度均为1.00mol/L的氨水和NaHCO3溶液中分别滴加1.00mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示。下列有关叙述正确的是

A. 曲线a是NaHCO3溶液的滴定曲线
B. 当V(盐酸)=4.00mL时,c(HCO3-)>c(NH4+)>c(CO32-)
C. 当V(盐酸)=15.00mL时,c(Na+)=c(NH4+)
D. 两个滴定过程均可选择酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如下所示的是某有机物分子的结构简式,其中带“*”的碳原子就是手性碳原子。当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是
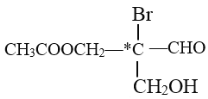
A. 与乙酸发生酯化反应 B. 与NaOH水溶液反应
C. 催化剂作用下与H2反应 D. 与银氨溶液作用只发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究某带结晶水的晶体X(仅含4种元素)的组成和性质,设计并完成了如下实验,其中甲、乙、丙均为常见物质。

请回答:(1)X中除H、O以外的非金属元素是______。
(2)固体乙与氨气在加热条件下反应也能得到单质丙,同时产生空气中含量最高的气体,写出该反应的化学方程式 ______。
(3)X的化学式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com