
【题目】以下12种物质为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2⑩Fe(OH)3 ![]() NaOH
NaOH ![]() NH3·H2O
NH3·H2O
请回答下列问题(填序号)。
(1)属于电解质的是_____。
(2)属于非电解质的是_____。
(3)在水溶液中能导电的电解质是_____。
(4)属于弱电解质的是_____。
【答案】②③⑤⑦⑧⑨⑩![]()
![]() ④ ②③⑤
④ ②③⑤![]()
![]() ⑨⑩
⑨⑩![]()
【解析】
(1)在水溶液里或熔融状态下都能导电的化合物是电解质,电解质必须是化合物,且电离出的离子是其本身电离的。②NaCl、③NaHSO4、⑤H2SO4、⑦CaCO3、⑧BaSO4、⑨Cu(OH)2、⑩Fe(OH)3、![]() NaOH、
NaOH、![]() NH3·H2O这几种物质的水溶液或熔融状态都能导电,所以是电解质。
NH3·H2O这几种物质的水溶液或熔融状态都能导电,所以是电解质。
故答案为:②③⑤⑦⑧⑨⑩![]()
![]() ;
;
(2)在水溶液里和熔融状态下都不能导电的化合物是非电解质,④SO3属于非电解质;
答案选④;
(3)在水溶液中能导电的电解质,有自由移动的离子,②NaCl、③NaHSO4、⑤H2SO4、![]() NaOH、
NaOH、![]() NH3·H2O是在水溶液中能导电的电解质;
NH3·H2O是在水溶液中能导电的电解质;
故答案为:②③⑤![]()
![]() ;
;
(4)在水溶液中只有部分电离的电解质是弱电解质。⑨Cu(OH)2、⑩Fe(OH)3、![]() NH3·H2O在水溶液里只有部分电离,均是弱电解质;
NH3·H2O在水溶液里只有部分电离,均是弱电解质;
故答案为:⑨⑩![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图所示是25℃时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
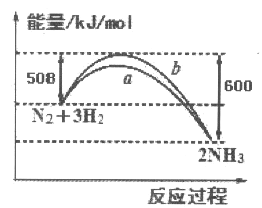
A. 该反应为放热反应
B. b曲线是表示加入了催化剂时的能量变化曲线
C. 加入催化剂,增加了反应的热效应
D. 反应开始通入1 mol N2和3 mol H2,反应后放出的热量一定为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1 mol/L的HClO2和1 mol/L的HMnO4两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是

A. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B. 在0≤pH≤5时,HMnO4溶液满足![]()
C. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
D. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH: NaMnO4>NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为_________________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在____________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式:_________。
③NO2尾气常用NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2-的水解常数K=2×10-11,常温下某NaNO2和HNO2混合溶液的pH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为__________。
II.T ℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) CO2(g)+NO(g),化学反应速率v =k Pm(CO)Pn(NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:

(3)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v =___________ kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl):试剂________,离子方程式___________。
(2)CO2(HCl):试剂________,离子方程式__________。
(3)![]() (CO
(CO![]() )试剂______________________,离子方程式______
)试剂______________________,离子方程式______
(4)C粉(Fe2O3):试剂____,离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下浓度均为1×10﹣3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④硫酸铵、⑤氨水、⑥氢氧化钠溶液,回答下列问题:
(1)氨水的电离方程式为_______,硫酸铵在水溶液中水解的离子方程式为___________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③________⑥(填“>”、“=”或“<”),溶液中的离子浓度由大到小的顺序为____________________________。
(3)在某温度下(Kw=1×10﹣12),将100 mL的①与100 mL的⑥溶液混合后(假设混合后溶液的体积为混合前两溶液的体积之和),溶液的pH=_________。
(4)若将等体积的②、③溶液加热至相同温度后,溶液的pH ②_______③(填“>” 、“=”或“<”)。
(5)室温时,若用①滴定⑤,适宜的指示剂为_____,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,请写出相应反应的化学方程式:__________。
(2)装置B中饱和食盐水的作用是___________;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_______________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是_________填字母编号)。
编号 | I | II | III |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是__________________________,该现象__________(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是____________。
(5)装置F的作用是__________________,其烧杯中的溶液不能选用下列中的_____(填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com