
【题目】实验室需要0.1mol/LNaOH溶液500mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是______________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________________________。
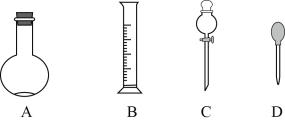
(2)在容量瓶的使用方法中,下列操作不正确的是______________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加入至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为_________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1mol/L(填“大于”、“小于”或“等于”)。
(4)根据计算得知,需用量筒取质量分数为98%,密度为1.84g/cm3的浓硫酸的体积______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。在实验中其他操作均正确,若量取浓硫酸时仰视刻度线,则所得溶液浓度______0.5mol/L(填“大于”、“小于”或“等于”)
【答案】C 烧杯和玻璃棒 BCD 2.0 小于 13.6mL 15mL 大于
【解析】
(1)配制溶液时,固体需用天平称量、液体需用量筒量取,然后放在烧杯内用玻璃棒搅拌溶解,冷却后转移入容量瓶,然后加水定容。
(2)A.使用容量瓶前,需检查是否漏水,以保证配制过程中溶质不损失;
B.容量瓶用水洗净后,不能用待配溶液洗涤;
C.配制溶液时,如果试样是固体,应先放在烧杯内溶解,冷却后转移定容;
D.配制溶液时,若试样是液体,应先放在烧杯内溶解,冷却后转移定容;
E.溶液定容完成后,盖好瓶塞,上下颠倒摇匀。
(3) 用托盘天平称取的质量为0.1mol/L ×0.5L×40g/mol。在实验中其他操作均正确,若定容时仰视刻度线,则所配溶液的体积偏大。
(4)利用稀释定律,可计算出需用量筒量取质量分数为98%,密度为1.84g/cm3的浓硫酸的体积;选择量筒时,规格尽可能小,但需一次量完。在实验中其他操作均正确,若量取浓硫酸时仰视刻度线,则所取浓硫酸体积偏大。
(1)配制溶液时,固体用天平、液体用量筒,然后放在烧杯内用玻璃棒搅拌溶解,冷却后转移入容量瓶,然后加水定容。在图中所示仪器中,配制上述溶液肯定不需要的是C,除图中已有仪器外,配制上述溶液还需要的玻璃仪器为烧杯和玻璃棒。答案为:C;烧杯和玻璃棒;
(2)A.使用容量瓶前,需检查是否漏水,以保证配制过程中溶质不损失,A正确;
B.容量瓶用水洗净后,不能用待配溶液洗涤,B不正确;
C.配制溶液时,如果试样是固体,应先放在烧杯内溶解,冷却后转移定容,C不正确;
D.配制溶液时,若试样是液体,应先放在烧杯内溶解,冷却后转移定容,D不正确;
E.溶液定容完成后,盖好瓶塞,上下颠倒摇匀,E正确;
故选BCD。答案为:BCD;
(3)用托盘天平称取的质量为0.1mol/L ×0.5L×40g/mol=2.0g。在实验中其他操作均正确,若定容时仰视刻度线,则所配溶液的体积偏大,则所得溶液浓度小于0.1mol/L。答案为:2.0;小于;
(4)设所需浓硫酸的体积为V,利用稀释定律,0.5mol/L×0.5L=![]() ,V=0.0136L=13.6mL;如果实验室有15mL、20mL、50mL量筒,应选用15mL量筒最好。在实验中其他操作均正确,若量取浓硫酸时仰视刻度线,则所取浓硫酸体积偏大,所得溶液浓度大于0.5mol/L。答案为:13.6mL;大于。
,V=0.0136L=13.6mL;如果实验室有15mL、20mL、50mL量筒,应选用15mL量筒最好。在实验中其他操作均正确,若量取浓硫酸时仰视刻度线,则所取浓硫酸体积偏大,所得溶液浓度大于0.5mol/L。答案为:13.6mL;大于。


科目:高中化学 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
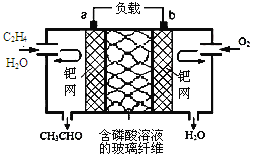
A.a电极发生还原反应
B.放电时,每转移2mol电子,理论上需要消耗28g乙烯
C.b极反应式为:O2+4e-+2H2O=4OH-
D.电子移动方向:电极a→磷酸溶液→电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N、Q的转化关系为,下列说法正确的是( )
![]()
A. M至N的反应类型是取代反应 B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q D. 0.3molQ与足量金属钠反应生成0.15NA个H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是

选项 | 实验 | 实验现象 | 结论 |
A | a | 左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl < AgBr < Ag2S |
D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,1mol N2与3mol H2完全反应生成2molNH3的能量变化曲线如图,下列叙述正确的是
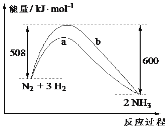
A.形成6 mol N—H键,吸收600 kJ能量
B.b曲线是加入催化剂时的能量变化曲线
C.该反应的ΔH=-92 kJmol-1
D.加入催化剂,能提高N2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-二异丙烯基苯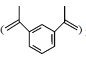 是重要的化工原料,下列说法正确的是( )
是重要的化工原料,下列说法正确的是( )
A.不可发生加聚反应B.不能使稀的高锰酸钾溶液褪色
C.分子中所有原子共平面D.其苯环上二氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是__,装置B中玻璃棒的作用是__,防止蒸发皿内溶液因局部过热而溅出。
(2)装置C中①的名称是__,①中加入沸石的作用是__,冷却水的方向是__。
(3)从氯化钠溶液中得到氯化钠固体,选择装置__(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置__。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加__,不产生白色沉淀表明Cl已除净。
查看答案和解析>>
科目:高中化学 来源: 题型:
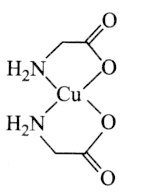
【题目】中国科学院研究员马大为以氨基酸铜的络合物为催化剂实现了碳![]() 氮键的高效构筑,为含苯胺片段的药物及材料的合成提供了一种简便、实用的方法,马大为借助这一研究也获得了“未来科学大奖物质科学奖”。如图是一种氨基酸铜的络合物的结构简式。
氮键的高效构筑,为含苯胺片段的药物及材料的合成提供了一种简便、实用的方法,马大为借助这一研究也获得了“未来科学大奖物质科学奖”。如图是一种氨基酸铜的络合物的结构简式。
回答下列问题:
![]() 基态铜原子的最外层电子所处的原子轨道的形状为________,某同学查阅资料发现铜有
基态铜原子的最外层电子所处的原子轨道的形状为________,某同学查阅资料发现铜有![]() 价,则基态
价,则基态![]() 的价电子轨道表达式为________。
的价电子轨道表达式为________。
![]() 、C、N、O四种元素的第一电离能由大到小的顺序为________
、C、N、O四种元素的第一电离能由大到小的顺序为________![]() 用元素符号表示
用元素符号表示![]() ;该氨基酸铜中碳原子的杂化方式为________;
;该氨基酸铜中碳原子的杂化方式为________;![]() 氨基酸铜中含有________
氨基酸铜中含有________![]() 键。
键。
![]() 、O元素可形成多种微粒,
、O元素可形成多种微粒,![]() 的空间构型为________,写出一种与
的空间构型为________,写出一种与![]() 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
![]() 铜晶体是面心立方结构,铜晶体的空间利用率为________;配位数为________。
铜晶体是面心立方结构,铜晶体的空间利用率为________;配位数为________。
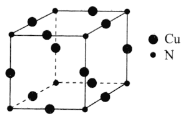
![]() 铜元素与氮元素形成的一种晶体的立方晶胞如图所示,该晶体的化学式为________,两个最近的氮原子之间的距离为anm,
铜元素与氮元素形成的一种晶体的立方晶胞如图所示,该晶体的化学式为________,两个最近的氮原子之间的距离为anm,![]() 表示阿伏加德罗常数的值,则该晶体的密度为________
表示阿伏加德罗常数的值,则该晶体的密度为________![]() 用含a、
用含a、![]() 的代数式表示
的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子可能大量共存的是
A.遇酚酞变红的溶液中:Na+、Cl-、Ba2+、CH3COO-
B.常温下,![]() =1×10-13mol·L-1的溶液中:SO
=1×10-13mol·L-1的溶液中:SO![]() 、Fe2+、ClO-、NH
、Fe2+、ClO-、NH![]()
C.水电离出的c(H+)=10-10mol·L-1的溶液中:Na+、K+、Cl-、HCO![]()
D.滴加KSCN溶液显红色的溶液中:NH![]() 、K+、Cl-、I-
、K+、Cl-、I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com