
【题目】中国科学院研究员马大为以氨基酸铜的络合物为催化剂实现了碳![]() 氮键的高效构筑,为含苯胺片段的药物及材料的合成提供了一种简便、实用的方法,马大为借助这一研究也获得了“未来科学大奖物质科学奖”。如图是一种氨基酸铜的络合物的结构简式。
氮键的高效构筑,为含苯胺片段的药物及材料的合成提供了一种简便、实用的方法,马大为借助这一研究也获得了“未来科学大奖物质科学奖”。如图是一种氨基酸铜的络合物的结构简式。
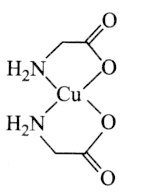
回答下列问题:
![]() 基态铜原子的最外层电子所处的原子轨道的形状为________,某同学查阅资料发现铜有
基态铜原子的最外层电子所处的原子轨道的形状为________,某同学查阅资料发现铜有![]() 价,则基态
价,则基态![]() 的价电子轨道表达式为________。
的价电子轨道表达式为________。
![]() 、C、N、O四种元素的第一电离能由大到小的顺序为________
、C、N、O四种元素的第一电离能由大到小的顺序为________![]() 用元素符号表示
用元素符号表示![]() ;该氨基酸铜中碳原子的杂化方式为________;
;该氨基酸铜中碳原子的杂化方式为________;![]() 氨基酸铜中含有________
氨基酸铜中含有________![]() 键。
键。
![]() 、O元素可形成多种微粒,
、O元素可形成多种微粒,![]() 的空间构型为________,写出一种与
的空间构型为________,写出一种与![]() 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
![]() 铜晶体是面心立方结构,铜晶体的空间利用率为________;配位数为________。
铜晶体是面心立方结构,铜晶体的空间利用率为________;配位数为________。
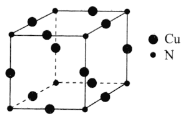
![]() 铜元素与氮元素形成的一种晶体的立方晶胞如图所示,该晶体的化学式为________,两个最近的氮原子之间的距离为anm,
铜元素与氮元素形成的一种晶体的立方晶胞如图所示,该晶体的化学式为________,两个最近的氮原子之间的距离为anm,![]() 表示阿伏加德罗常数的值,则该晶体的密度为________
表示阿伏加德罗常数的值,则该晶体的密度为________![]() 用含a、
用含a、![]() 的代数式表示
的代数式表示![]() 。
。
【答案】球形 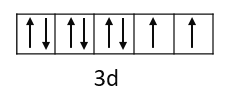
![]()
![]() 、
、![]() 2 正四面体形
2 正四面体形 ![]()
![]() 12
12 ![]()
![]()
【解析】
![]() 为29号元素,基态Cu原子电子排布式为1s22s22p63s23p63d104s1;
为29号元素,基态Cu原子电子排布式为1s22s22p63s23p63d104s1;
(2)C、N、O为同周期主族元素,第一电离能随核电荷数增大呈增大趋势,但N的2p轨道为半充满结构,相对稳定;
![]() 中N的杂化轨道数
中N的杂化轨道数![]() ,采用
,采用![]() 杂化;
杂化;
![]() 铜晶体为面心立方结构,设Cu的原子半径为r,则边长a与半径r满足
铜晶体为面心立方结构,设Cu的原子半径为r,则边长a与半径r满足![]() ,求得
,求得![]() ,据此计算空间利用率
,据此计算空间利用率 ;
;
![]() 每个晶胞含有Cu:
每个晶胞含有Cu:![]() ,含有N:
,含有N:![]() ,故晶体的化学式为
,故晶体的化学式为![]() ,每个晶胞的质量
,每个晶胞的质量![]() ,晶胞的体积
,晶胞的体积![]() ,再结合
,再结合![]() 计算即可。
计算即可。
![]() 为29号元素,最外层为span>4s电子,s原子轨道呈球形;基态
为29号元素,最外层为span>4s电子,s原子轨道呈球形;基态![]() 的价电子轨道表达式为:
的价电子轨道表达式为: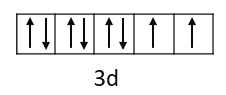 ;
;
![]() 的2p轨道为半充满结构,故N的第一电离能比C和O大,Cu为金属,第一电离能最小,故第一电离能:
的2p轨道为半充满结构,故N的第一电离能比C和O大,Cu为金属,第一电离能最小,故第一电离能:![]() ;该氨基酸铜中含有双键的碳原子杂化方式为
;该氨基酸铜中含有双键的碳原子杂化方式为![]() ,以单键连接其它原子的杂化方式为
,以单键连接其它原子的杂化方式为![]() ;
;![]() 中有一个
中有一个![]() 键,故1mol氨基酸铜含有
键,故1mol氨基酸铜含有![]() 键;
键;
![]() 中N的杂化轨道数
中N的杂化轨道数![]() ,采用
,采用![]() 杂化,空间构型为正四面体形;
杂化,空间构型为正四面体形;![]() 与
与![]() 原子总数相同,价电子总数相同,互为等电子体;
原子总数相同,价电子总数相同,互为等电子体;
![]() 铜晶体为面心立方结构,设Cu的原子半径为r,则边长a与半径r满足
铜晶体为面心立方结构,设Cu的原子半径为r,则边长a与半径r满足![]() ,求得
,求得![]() ,所以空间利用率
,所以空间利用率 ,每个铜原子距离最近的铜原子数为12,配位数为12;
,每个铜原子距离最近的铜原子数为12,配位数为12;
![]() 每个晶胞含有Cu:
每个晶胞含有Cu:![]() ,含有N:
,含有N:![]() ,故晶体的化学式为
,故晶体的化学式为![]() ,每个晶胞的质量
,每个晶胞的质量![]() ,晶胞的体积
,晶胞的体积![]() ,故晶胞的密度
,故晶胞的密度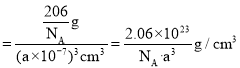 。
。


科目:高中化学 来源: 题型:
【题目】伞形花内酯的一种制备方法如下:
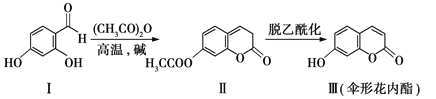
下列说法不正确的是
A.Ⅰ、Ⅱ、Ⅲ均能发生水解反应
B.Ⅰ、Ⅱ、Ⅲ均能使溴水褪色
C.检验化合物Ⅱ中是否混有化合物Ⅰ,可用FeCl3溶液
D.与化合物Ⅰ官能团种类、数目均相同且含有苯环的同分异构体有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液500mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是______________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________________________。
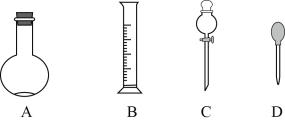
(2)在容量瓶的使用方法中,下列操作不正确的是______________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加入至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为_________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1mol/L(填“大于”、“小于”或“等于”)。
(4)根据计算得知,需用量筒取质量分数为98%,密度为1.84g/cm3的浓硫酸的体积______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。在实验中其他操作均正确,若量取浓硫酸时仰视刻度线,则所得溶液浓度______0.5mol/L(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
![]() 基态
基态![]() 的价层电子排布图
的价层电子排布图![]() 轨道表达式
轨道表达式![]() 为________,C、N、O的第一电离能从小到大的顺序为________
为________,C、N、O的第一电离能从小到大的顺序为________
![]() 、P可形成一些复杂离子,如
、P可形成一些复杂离子,如![]() 、
、![]() 、
、![]() 等。
等。
![]() 中N原子的杂化类型为________,
中N原子的杂化类型为________,![]() 的空间构型是为________
的空间构型是为________
![]() 是一种白色固体,在加压下于
是一种白色固体,在加压下于![]() 时液化,形成一种能导电的熔体。熔体能导电的原因是________
时液化,形成一种能导电的熔体。熔体能导电的原因是________
![]() 、Ni易与
、Ni易与![]() 与
与![]() 互为等电子体
互为等电子体![]() 形成配合物,
形成配合物,![]() 中
中![]() 键与
键与![]() 键个数比为________,
键个数比为________,![]() 熔点
熔点![]() ,沸点
,沸点![]() ,不溶于水,溶于乙醇、苯等有机溶剂,
,不溶于水,溶于乙醇、苯等有机溶剂,![]() 属于________晶体
属于________晶体
![]() 、NiO的晶体类型与结构和NaCl相同。
、NiO的晶体类型与结构和NaCl相同。
![]() 熔点FeO________
熔点FeO________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
![]() 晶胞如下图,
晶胞如下图,![]() 的配位数为________
的配位数为________

![]() 在氧气中加热,部分
在氧气中加热,部分![]() 被氧化为
被氧化为![]() ,晶体结构产生铁离子缺位的缺陷,其组成变为
,晶体结构产生铁离子缺位的缺陷,其组成变为![]() ,测得晶胞边长为acm,密度为
,测得晶胞边长为acm,密度为![]() ,则
,则![]() ________
________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用Fe3+与I-间的反应探究氧化还原反应规律与平衡移动原理的取系,回答下列问题:
(1)用Fe2(SO4)3晶体配制100mL0.05mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓硫酸中,再用水稀释,加入硫酸的目的是_______(结合化学用语回答)。
(2)甲组同学将0.10mol/L的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液各5mL混合充分反应后,溶液变为棕黄色,现进行如下实验①② 。

实验①中产生蓝色沉淀的离子方程式为_________,根据以上反应现象写出甲组同学实验中的离了方程式_________,在甲组同学的反应中,I2和Fe3+的氧化性强弱顺序为_________。
查阅资料:其它条件相同时,物质的氧化性及还原性强弱随浓度大小发生变化。
(3)乙组同学以下图实验装置进一步探究上述反应,

K闭合时,指针发生偏转,盐桥中的阳离子向______极(填“a”或“b”)定向移动;当指针归零时,向烧杯I中满加0.01mol/L AgNO3溶液,指针反向偏转,表明平衡发生了移动。据此分析I-还原性强弱与浓度关系______________。
(4)丙组同学欲测定甲组同学所得棕黄色溶液中c(I2),已知I2+2Na2S2O3=2NaI+Na2S4O6。现借助酸碱中和滴定相关仪器,用cmol·L-1的Na2S2O3溶液在弱碱性环境下对该溶液进行滴定,消耗Na2S2O3溶液VmL。
①Na2S2O3溶液装入______(填“酸式”或“碱式”)滴定管,选用淀粉济液为指示剂,滴定终点现象为_______________。
②老师提出丙组同学方案不可行,原因一是Fe3+可能氧化Na2S2O3,二是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
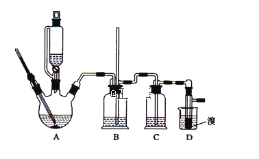
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度等特性,被美誉为“未来钢铁”“战略金属”。
![]() 基态钛原子核外电子有________种不同的空间运动状态,基态钛原子简化的电子排布式为________,区分晶态
基态钛原子核外电子有________种不同的空间运动状态,基态钛原子简化的电子排布式为________,区分晶态![]() 和非晶态
和非晶态![]() 最可靠的科学方法是对固体进行________。
最可靠的科学方法是对固体进行________。
![]() 钙钛矿
钙钛矿![]() 可应用于发光二极管。与钙元素同周期且最外层电子数相同的元素有种,氧元素可以与氯元素形成化合物
可应用于发光二极管。与钙元素同周期且最外层电子数相同的元素有种,氧元素可以与氯元素形成化合物![]() ,其中氧原子的杂化方式为________,
,其中氧原子的杂化方式为________,![]() 的空间构型为________。
的空间构型为________。
![]() 在浓的
在浓的![]() 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为![]() 的绿色晶体,该晶体中两种配体的物质的量之比为
的绿色晶体,该晶体中两种配体的物质的量之比为![]() ,则该配离子的化学式为________。
,则该配离子的化学式为________。
![]() 钛在较高温度下可与氧或氮元素及其化合物发生反应,O、N元素形成的简单氢化物的键角前者小于后者的原因是________。
钛在较高温度下可与氧或氮元素及其化合物发生反应,O、N元素形成的简单氢化物的键角前者小于后者的原因是________。
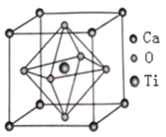
![]() 钛酸钙的晶胞结构如图所示,晶胞中两个最近的氧原子之间的距离为apm,晶胞中钛的氧配位数为________,晶胞的密度为________
钛酸钙的晶胞结构如图所示,晶胞中两个最近的氧原子之间的距离为apm,晶胞中钛的氧配位数为________,晶胞的密度为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究Cu与NO的反应,查阅资料:①Cu与NO反应可生成CuO和N2,②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
(1)实验室利用Cu和稀HNO3制备NO,写出反应的化学方程式_____________。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:
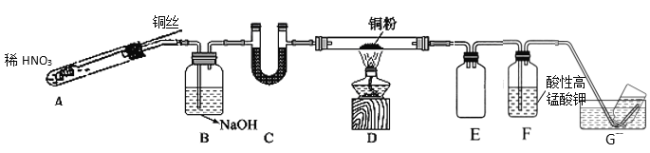
①使用铜丝的优点是_____________________装置E的作用为_______________。
②装置C中盛放的药品可能是_________;
③装置D中的现象是_______________;装置F中反应的离子方程式是_______________。
(3)测定NaNO2和NaNO3 混合溶液中NaNO2的浓度。 取25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
d.酸性KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后用待测液润洗
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③NaNO2 的物质的量浓度为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色而有刺激性气味的甲酸,是最简单的羧酸液体,熔点8.6℃,沸点100.8℃。化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为:HCOOH![]() CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。
CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。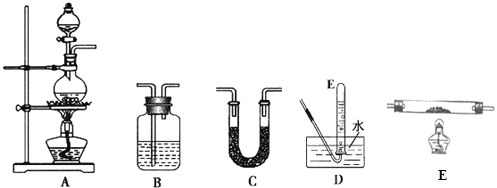
(1)请从图中选用所需的仪器(仪器可重复使用)组成一套验证甲酸(HCOOH)和浓硫酸加热生成产物的实验装置。现提供以下药品:甲酸、浓硫酸、无水硫酸铜、氧化铜粉末、澄清石灰水。将所用仪器的序号按连接顺序由上至下依次填入下表(可以不填满),并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写)。___
选用的仪器 | 加入的试剂 |
A | 甲酸、浓硫酸 |
D | -- |
证明有一氧化碳生成的现象是___。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)24H2O]晶体。查阅资料可知四水甲酸铜晶体为浅蓝色晶体,可溶于水,难溶于醇。
相关的化学方程式是:2CuSO4+4NaHCO3=Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4+H2O;Cu(OH)2CuCO3+4HCOOH+5H2O=2Cu(HCOO)24H2O+CO2↑
实验步骤如下:
Ⅰ.碱式碳酸铜的制备:
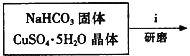
![]()
![]()
①步骤ⅰ是将一定量CuSO45H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到___(填写实验现象),说明温度过高。
Ⅱ.甲酸铜的制备:将Cu(OH)2CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的![]() 时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
③制取甲酸铜时需要趁热过滤的原因是___。
④用无水乙醇洗涤晶体的目的是___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com