
����Ŀ��ijͬѧ̽��Cu��NO�ķ�Ӧ���������ϣ���Cu��NO��Ӧ������CuO��N2�������������£�NO��NO2�C������MnO4�C��Ӧ����NO3�C��Mn2+
��1��ʵ��������Cu��ϡHNO3�Ʊ�NO��д����Ӧ�Ļ�ѧ����ʽ_____________��
��2��ѡ����ͼ��ʾװ�����Cu��NO��ʵ�顣(�г�װ����) ʵ�鿪ʼǰ����װ����ͨ��һ��ʱ���N2���ش��������⣺
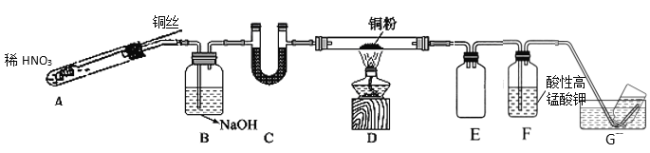
��ʹ��ͭ˿���ŵ���_____________________װ��E������Ϊ_______________��
��װ��C��ʢ�ŵ�ҩƷ������_________��
��װ��D�е�������_______________��װ��F�з�Ӧ�����ӷ���ʽ��_______________��
��3���ⶨNaNO2��NaNO3 �����Һ��NaNO2��Ũ�ȡ� ȡ25.00mL�����Һ����ƿ�У���0.1000mol��L��1����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.90 | 20.12 | 20.00 | 19.88 |
����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������_________������ĸ���ţ���
a����ƿϴ����δ����
b����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
c���ζ��յ�ʱ���Ӷ���
d������KMnO4��Һ�к��������������Լ�
e����ƿϴ�����ô���Һ��ϴ
������KMnO4��Һ�ζ�����������Һ�����ӷ���ʽΪ___________________��
��NaNO2 �����ʵ���Ũ��Ϊ__________
���𰸡�3Cu +8HNO3 =3 Cu(NO3)2 + 2NO�� + 4H2O ���Կ��Ʒ�Ӧ�ķ�����ֹͣ ��ȫƿ���������� CaCl2��P2O5 ��轺 ���ʯ�ҵȣ������𰸶����֣� ��ɫ��ĩ��� 5NO +3MnO4- + 4H+= 5NO3- + 3 Mn2+ + 2H2O bce 6H��+2MnO4��+5NO2��=2Mn2��+5NO3��+3H2O 0.2mol/L
��������
��1��Cu���������������ݵ����غ��Ԫ���غ���ƽ����ʽ��
��2��ʵ�鿪ʼǰ����װ����ͨ��һ��ʱ���N2����װ���ڵĿ����ž���ͭ˿��ϡ���ᷴӦ����һ��������װ��B��ȥ���ܻ��еĶ���������װ��C���и��֮����Dװ���н��з�Ӧ��Eװ�ö̽��̳���֪��Ϊ��ȫƿ��Fװ�ô���δ��Ӧ��һ��������Gװ���ռ�������
��3���ٵ�һ��ʵ�����ݳ����쳣������KMnO4��Һ���ƫ����c�����⣩=![]() ��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
�ڸ÷�Ӧ������������ӱ�����Ϊ��������ӣ�����������ӱ���ԭΪ�����ӣ�
��ͨ������ʽȷ���������ƺ������֮���������ϵ���м��㣻
��1��Cu���������������ݵ����غ��Ԫ���غ���ƽ����ʽ��
�ʴ�Ϊ��3Cu +8HNO3 =3 Cu(NO3)2 + 2NO�� + 4H2O��
��2���ٿ�ͨ�������ƶ�ͭ˿���Ʒ�Ӧ�Ƿ���У�����ʹ��ͭ˿���ŵ��ǿ��Կ��Ʒ�Ӧ�ķ�����ֹͣ��װ��E�̽��̳�������Ϊ��ȫƿ��������
�ʴ�Ϊ�����Կ��Ʒ�Ӧ�ķ�����ֹͣ����ȫƿ������������
��װ��C�������Ǹ������ʢ�ŵ�ҩƷ�����Ǽ�ʯ�ҡ���ˮ�Ȼ��Ƶȣ�
�ʴ�Ϊ��CaCl2��P2O5 ��轺 ���ʯ�ҵȣ������𰸶����֣���
��װ��D��һ��������ͭ��Ӧ��������ͭ��ͭ����Ϊ��ɫ������ͭΪ��ɫ�����Կ����������Ǻ�ɫ��ĩ��ڣ�װ��F�и�����ؽ�һ����������������������ݵ����غ��Ԫ���غ��֪��Ӧ�����ӷ���ʽ��5NO +3MnO4- + 4H+= 5NO3- + 3 Mn2+ + 2H2O��
�ʴ�Ϊ����ɫ��ĩ��ڣ�5NO +3MnO4- + 4H+= 5NO3- + 3 Mn2+ + 2H2O��
��3����a����ƿϴ����δ�������Һ�����ʵ������䣬��V��������Ӱ�죬�ʴ���
b����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ��Һ��Ũ��ƫС�����V������ƫ����ȷ��
c���ζ��յ�ʱ���Ӷ��������V������ƫ����ȷ��
d������KMnO4��Һ�к��������������Լ��ᵼ�� V������ƫС���ʴ���
e����ƿϴ�����ô���Һ��ϴ���´���Һ���ƫ�����V������ƫ����ȷ��
�ʴ�Ϊ��bce��
�ڸ÷�Ӧ������������ӱ�����Ϊ��������ӣ�����������ӱ���ԭΪ�����ӣ����ӷ���ʽΪ2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O��
�ʴ�Ϊ��2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O��
�۸��ݷ���ʽ��֪��5NO2-~2MnO4-�����ĵĸ���������Ϊ(20.12mL+20.00mL +19.88mL)/3=20.00mL�� ��c(NaNO2)= = 0.2mol/L��
= 0.2mol/L��
�ʴ�Ϊ��0.2mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش��������⣺
��1�����ķ���ϩ��һ�����壬������һ����ƽ�����������ϸ�����λ����Ķ��ؾ��壬��ͨ��___�������־�������ͷǾ��塣
��2��[H2F]+[SbF6]-�������ᣩ��һ�ֳ�ǿ�ᣬ����[H2F]+�������ӵĿռ乹��Ϊ___��
��3��NH4F������泥������ڲ�����ʴ�̡������������������������Һ�д���__������ĸ����
a.���Ӽ� b.���� c.���� d.��� e.��λ��
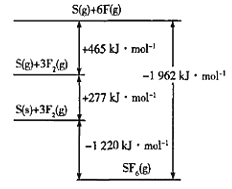
��4��SF6���㷺������ѹ�����豸�ľ�Ե���ʡ�SF6��һ�ֹ��ۻ������ͨ��������Born-Haberѭ��������������ͼ������ؼ��ܡ���F-F���ļ���Ϊ____kJmol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ�ش���������
I.����ȼ�ϵ������ʽ�ͼ�ʽ���֣����Ƿŵ�ʱ�ĵ���ܷ�Ӧ��Ϊ2H2+O2 = 2H2O��
(1)����ʱ���������Һ�е�����������_______��(����������������)��
(2)��ʽ����ȼ�ϵ�صĵ������Һ��ϡ���ᣬ�������ĵ缫��ӦΪ________��
(3)��ʽ����ȼ�ϵ�صĵ������Һ��KOH��Һ���为���ĵ缫��ӦΪ_______��
II.ͨ��NO�������ɼ������β����NO�ĺ������乤��ԭ����ͼ��ʾ��O2-���ڹ��������������ƶ���
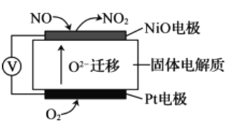
(1)NiO�缫�Ϸ�������________��Ӧ(����������������ԭ��)��
(2)���·�У������Ǵ�_________�缫����(����NiO������Pt��)��
(3)Pt�缫�ĵ缫��ӦΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��������ͼװ��̽���¶ȶ�CO��ԭFe2O3��Ӱ��(�̶�װ����)
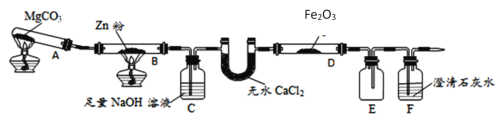
(1)ͼ��ʢ��ˮCaCl2����������Ϊ______װ��B�еĻ�ѧ��Ӧ����ʽΪ_______��
(2)װ��C�з�����Ӧ�����ӷ���ʽΪ_________������β���ķ���Ϊ________��
(3)���о�С���Ϊ���飬����ͼװ�ý��жԱ�ʵ�飬̽����ͬ�¶������º�ɫ����ijɷ֣������þƾ��ơ������þƾ���ƶ�װ��D���ȣ���Ӧ�����Ϊ��ɫ��ĩ(������)������ֱ��ò����������ʵ�飺
���� | ���� | �������� | �������� |
1 | ȡ��ɫ��ĩ�������� | �ܽ⣬������ | �ܽ⣬������ |
2 | ȡ����1����Һ���μ�K3[Fe(CN)6]��Һ | ��ɫ���� | ��ɫ���� |
3 | ȡ����1����Һ���μ�KSCN��Һ | ��� | ������ |
4 | ȡ����3��Һ�еμ�������ˮ | ��ɫ��ȥ | �ȱ�죬����ɫ |
������õ��ĺ�ɫ��ĩ�ɷ���________��
�ڸ��ݼ���ʵ������д�����鲽��1�з�Ӧ�����ӷ�ʽ__________��
�����鲽��4�У���Һ����ԭ��Ϊ________����Һ��ɫ���ܵ�ԭ��________������֤����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.MnO2��Ũ���ᷴӦ��Cl2��MnO2+4HCl![]() Mn2��+2Cl��+Cl2��+2H2O
Mn2��+2Cl��+Cl2��+2H2O
B.��������ˮ����Al(OH)3���壺Al3��+3H2O =Al(OH)3��+3H��
C.Na2O2����ˮ����O2��Na2O2+H2O =2Na��+2OH��+O2��
D.Ca(HCO3)2��Һ������NaOH��Һ��Ӧ��HCO3��+Ca2��+OH��= CaCO3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�ǻ������л�����ԭ�ϣ��ɱ�ϩ�����²���ɺϳ�N�������ϩ������������ںϳ����¶ȱ仯��ҩ������ͷŲ��ϡ�
![]()
��1����ϩ�Ľṹ��ʽΪ___��
��2����Ӧ��ķ�Ӧ����Ϊ___��
��3����Ӧ��___����������������������������KMnO4��Һ��Ϊ��������������___��
��4���������ɵ�B���Ƿ���A�ķ�����___��д���йط�Ӧ�Ļ�ѧ����ʽ��___��
��5��M��A����Ϊͬϵ���Է���������A��14��д��M���п��ܵĽṹ��ʽ___��
��6����B����������������Ƴ�ǿ��ˮ����֬N��N����___�������������������������߷��Ӳ��ϣ�N�Ľṹ��ʽ�ɱ�ʾΪ___��
��7����Ӧ�����һ�ַ�Ӧ��Ľṹ��ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��ԭ�ӽṹ�Ļ�ѧ������,�Ժ�������˶�״̬������ȷ���ܾݴ�ȷ�������ܼ����ǣ� ��
A.![]() B.
B.![]() C.1s22s22p3D.
C.1s22s22p3D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100 mL 1 mol��L��1�İ�ˮ��100 mL a mol��L��1����������ϣ����Է�Ӧ���Ⱥ�����仯�������й����۲���ȷ����
A. ����Ϻ���ҺpH��7����c(NH4��)��c(Cl��)
B. ��a��2����c(Cl��)>c(NH4��)>c(H��)>c(OH��)
C. ��a��0.5����c(NH4��)>c(Cl��)>c(OH��)>c(H��)
D. ����Ϻ���Һ����c(H��)��c(OH��)��c(NH3��H2O)������Ƴ�a��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȫȼ�յĻ�ѧ����ʽΪ��Si+O2![]() SiO2��1 mol Si��ȫȼ������SiO2�ų�992kJ����������֪����1mol Si-Si����1mol O=O����1mol Si-O�����յ������ֱ�Ϊ176kJ��496kJ��460kJ������ṹ֪ʶ�������ǣ�1mol SiO2�к���4mol Si-O������1molSi�к���Si-Si�������ʵ���Ϊ( )
SiO2��1 mol Si��ȫȼ������SiO2�ų�992kJ����������֪����1mol Si-Si����1mol O=O����1mol Si-O�����յ������ֱ�Ϊ176kJ��496kJ��460kJ������ṹ֪ʶ�������ǣ�1mol SiO2�к���4mol Si-O������1molSi�к���Si-Si�������ʵ���Ϊ( )
A. 1mol B. 2mol C. 3mol D. 4mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com