
【题目】高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图。下列说法不正确的是

A. 酸溶时,常需将烧渣粉碎、并加入过量H2SO4,其目的是提高铁元素的浸出率,同时抑制铁离子的水解
B. 反应②的离子方程式为:FeS2+14Fe3++8H2O=15Fe2++2S042-+16H+
C. 加入NH4HCO3生成FeCO3,检验FeCO3是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴如盐酸酸化的氯化钡溶液,若无沉淀生成说明洗涤干净
D. 锻烧时空气中的氧气作氧化剂,所以用氯气代替空气也可得到高纯氧化铁
【答案】D
【解析】
本题考查的是物质的制备和分离操作,侧重于学生的分析能力、实验能力和综合运用化学知识能力的考查,为高考常见题型,注意根据实验流程以及相关物质的性质解答该题。
A.烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)酸浸时Fe2O3、Fe3O4、FeO能与稀硫酸反应得到亚铁离子和铁离子,酸浸时,常需要将烧渣粉碎,通过增大接触面积,提高铁元素的浸出率,因亚铁离子和铁离子都容易水解成酸性,通过加入过量硫酸,抑制水解,故正确;B.滤液中加入FeS2+将铁离子还原为亚铁离子,-1价的硫被氧化生成+6价的硫,FeS2 - S042-,失去14e-,Fe3+ -Fe2+,得到e-,最小公倍数为14,根据得失电子守恒、原子守恒和电荷守恒,离子反应方程式为FeS2+14Fe3++8H2O=15Fe2++2S042-+16H+,故正确;C.碳酸氢铵能和酸反应生成硫酸铵和二氧化碳,同时能调节溶液的pH,使亚铁离子全部转化为碳酸亚铁,过滤得到碳酸亚铁,滤液中有硫酸铁,所以操作为取最后一次洗涤滤液,滴加 酸化排除碳酸根离子的干扰,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净,故正确;D.煅烧时空气中的氧气做氧化剂,用氯气代替空气会生成氯化铁,不能得到高纯氧化铁,故错误。故选D。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol/L的稀盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用________量筒。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面距容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度会______(填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶,则配制的稀盐酸浓度会________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物H 是一种仿生高聚物(![]() )的单体。由化合物A(C4H8)制备H的一种合成路 线如下 :
)的单体。由化合物A(C4H8)制备H的一种合成路 线如下 :
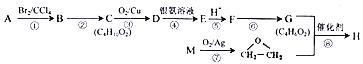
已知: A 与M 互为同系物。回答下列问题:
(1) A的系统命名为_____________。F分子中含有的官能团名称为__________________。
(2) B→C的反应条件为______________________。反应③、⑥的反应类型分别为_________、_________。
(3) 反应⑧的化学方程式为___________________________________。
(4) 化合物X 为H 的同分异构体,X 能与新制的氢氧化铜悬浊液反应生成砖红色沉淀,还能与Na2CO3饱和溶液反应放出气体,其核磁共振氢谱有4 种峰。写出两种符合要求的X 的结构简式________________。
(5) 根据上述合成中的信息,试推写出以乙烯为原料经三步制备CH3-COOCH=CH2的合成路线__________(其他试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | I A | IIA | IIIA | IVA | V A | VIA | VIIA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1) 在这些元素中,在这些元素中,化学性质最不活泼的是:________________(填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物是_________,碱性最强的化合物是/span>_________。
(3) 最高价氧化物是两性氧化物的元素是_________。
(4) 元素④与⑥形成的化合物属于___________________ (填“共价”或“离子”)化合物。
(5)①与⑦形成的化合物的化学式 __________________。
(6)写出⑥的原子结构示意图_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定混合均匀的NH4NO3和(NH4)2SO4样品组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(溶液中的铵根离子全部转化为氨气,且加热后氨气全部逸出).加入的混合物的质量和产生的气体体积(标准状况)的关系如表:
实验序号 | I | II | III | IV |
NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=_____g;c(NaOH)=_____molL﹣1。
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2与NO2的下列说法正确的是
A. 都能引起光化学烟雾 B. 都能使石蕊试液先变红后褪色
C. 都是酸性氧化物 D. 都能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2 + H2O![]() H+ + Cl-+HClO
H+ + Cl-+HClO
B. CaCO3加入醋酸中:CO![]() + 2H+ = CO2↑ + H2O
+ 2H+ = CO2↑ + H2O
C. 用惰性电极电解MgCl2溶液:2Cl-+2H2O ![]() H2↑+ Cl2↑ +2OH-
H2↑+ Cl2↑ +2OH-
D. 酸性KMnO4溶液滴入FeSO4溶液中:MnO![]() + Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
+ Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com