
【题目】燃煤和汽车尾气是造成空气污染的原因之一,雾疆天气肆虐给人类健康带来了严重影响,化学在解决雾霾污染中发挥了重要作用。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
己知:
CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1
2NO2(g) ![]() N2O4(g) △H=-56.9kJ·mol-1
N2O4(g) △H=-56.9kJ·mol-1
H2O(g)=H2O(l) △H=-44.0kJ·mol-1
①写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式________________。
②反应CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(l)在恒温恒容容器中达到平衡,下列叙述不能作为判断该反应达到平衡状态标志的是___________。
N2(g)+CO2(g)+2H2O(l)在恒温恒容容器中达到平衡,下列叙述不能作为判断该反应达到平衡状态标志的是___________。
A.容器中的压强不变 B.混合气体的密度不变
C.2v正(NO2)= v 逆(N2) D.c(CH4)= c(N2)
(2)CO、CO2 是火力发电厂及汽车尾气的主要成分,为减少对环境造成的影响,采用以下方法将其资源化利用。
①以CO 为电极燃料,以熔融K2CO3为电解质,和O2组成燃料电池。请写出该电池的负极电极反应式_____________________。
②在铝矾土作催化剂、773K条件下,3molCO与1.5molSO2反应生成3molCO2和0.75mol硫蒸气,该反应可用于从烟道气中回收硫,写出该反应的化学方程式_______________。
③在汽车的排气管上增加一个补燃器,并不断补充O2使其浓度保持为4.0×10-4mol·L-1,发生反应2CO(g)+O2(g) ![]() 2CO2(g)。某温度下测得汽车尾气中CO、CO2 气体的浓度分别为2.0×10-6 mol·L-1、4.0×10-4 mol·L-1,则该条件下反应的平衡常数K=___________。
2CO2(g)。某温度下测得汽车尾气中CO、CO2 气体的浓度分别为2.0×10-6 mol·L-1、4.0×10-4 mol·L-1,则该条件下反应的平衡常数K=___________。
【答案】CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l) △H=-898.1kJ·mol-1 CD CO-2e-+CO32-=2CO2 4CO+2SO2![]() 4CO2+S2 1.0×108L·mol-1
4CO2+S2 1.0×108L·mol-1
【解析】
(1)①CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1;
N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1;
②2NO2(g) ![]() N2O4(g) △H=-56.9kJ·mol-1;③H2O(g)=H2O(l) △H=-44.0kJ·mol-1,盖斯定律可知,由①-②+③×2即CH4催化还原N2O4(g)生成N2和H2O(l)热化学方程式,
N2O4(g) △H=-56.9kJ·mol-1;③H2O(g)=H2O(l) △H=-44.0kJ·mol-1,盖斯定律可知,由①-②+③×2即CH4催化还原N2O4(g)生成N2和H2O(l)热化学方程式,
CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l) △H=-898.1kJ·mol-1;②反应CH4(g)+ 2NO2(g) ![]() N2(g)+CO2(g)+2H2O(l),A.由于反应前后压强不同,当容器中的压强不变即反应达到平衡,B.由气体质量有变化、容积不变,则混合气体的密度不变能说明应达到平衡,C. v正(NO2)/v逆(N2)=1/2,不等于计算数之比,不能说明应达到平衡,D.c(CH4)=c(N2)不一定达到平衡,故答案选CD。
N2(g)+CO2(g)+2H2O(l),A.由于反应前后压强不同,当容器中的压强不变即反应达到平衡,B.由气体质量有变化、容积不变,则混合气体的密度不变能说明应达到平衡,C. v正(NO2)/v逆(N2)=1/2,不等于计算数之比,不能说明应达到平衡,D.c(CH4)=c(N2)不一定达到平衡,故答案选CD。
(2)①CO在负极失去电子,与碳酸根离子结合生成二氧化碳,负 极电极反应式为:CO-2e-+CO32-=2CO2;②由物质的量之比等于计算量数之比,根据质量守恒可写出此反应:4CO+2SO2 ![]() 4CO2+S2;③该条件下反应的平衡常数K=c2(CO2)/ c2(CO) c(O2)=( 4.0×10-4)2/( 2.0×10-6)2( 4.0×10-4)= 1.0×108L·mol-1。
4CO2+S2;③该条件下反应的平衡常数K=c2(CO2)/ c2(CO) c(O2)=( 4.0×10-4)2/( 2.0×10-6)2( 4.0×10-4)= 1.0×108L·mol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】可逆反应达到最大反应限度的本质特征是( )
A.正反应不再继续进行
B.正反应和逆反应都再继续进行
C.正反应和逆反应的速率都为零
D.正反应和逆反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________。
(3)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需________(填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是_______。
③某同学设计的下列滴定方式中,最合理的是________(夹持部分略去,填字母序号),达到滴定终点的现象是__________________________。
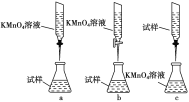
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程因发生取代反应而产生的是( )
A.乙烯使溴的四氯化碳溶液退色
B.将苯加入溴水中,振荡后水层接近无色
C.将苯、浓硫酸、浓硝酸混合后在55~60 ℃ 水浴中加热
D.液态植物油与氢气反应生成固态物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关葡萄糖的说法错误的是
A.葡萄糖的分子式是C6H12O6B.葡萄糖在催化剂的作用下可水解
C.葡萄糖是人体重要的能量来源D.葡萄糖能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,对上文进行的某些分析中正确的是
A. “洧水”的主要成分是油脂
B. “洧水”的主要成分是煤油
C. 烟的主要成分是炭黑
D. 烟的主要成分是石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法,不正确的是( )
A. 制作光纤产品可用晶体硅
B. 纸浆漂白可用二氧化硫
C. 游泳池消毒可用漂粉精
D. 人工降雨可用干冰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。
已知:①AlCl3、FeCl3分别在183 ℃、315 ℃时升华;②无水AlCl3遇潮湿空气变质。
Ⅰ. 实验室可用下列装置制备无水AlCl3。
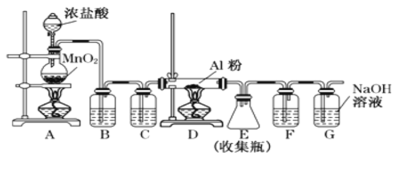
(1)组装好仪器后,首先应_____________,具体操作为_____________________
(2)装置 B中盛放饱和NaCl溶液,该装置的主要作用是__________________。装置C中盛放的试剂是________________。装置F中试剂的作用是__________。若用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为_______
(3)将所制得的无水AlCl3配制溶液时需加入盐酸的目的是_________
Ⅱ. 工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
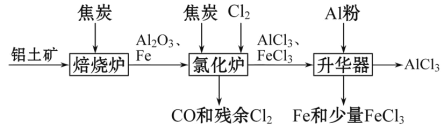
(1)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为___________________
(2)700 ℃时,升华器中物质充分反应后降温实现FeCl3和AlCl3的分离。温度范围应为_______
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(3)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
![]()
计算该样品中AlCl3的质量分数________(结果用m、n表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 A(g) + 2B(g) ![]() 2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
(1)升高温度,B的转化率_____________,v(正)____________,v(逆)____________。
(2)保持温度和压强不变,加入惰性气体,则C的物质的量_____________,A的转化率_____________。
(3) 保持温度和体积不变,加入惰性气体,A的转化率_____________。
(4)若温度和体积不变,反应从开始到平衡,容器内气体的密度_____________,压强____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com