
【题目】下列图象能正确反映对应的实验操作的是( )
A.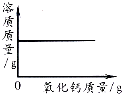 向一定量的饱和石灰水中加入氧化钙
向一定量的饱和石灰水中加入氧化钙
B.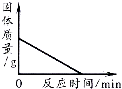 加热一定量高锰酸钾固体产生氧气
加热一定量高锰酸钾固体产生氧气
C.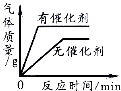 用一定量的双氧水制取氧气
用一定量的双氧水制取氧气
D.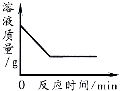 向一定量的硝酸银溶液中插入铜丝
向一定量的硝酸银溶液中插入铜丝
【答案】D
【解析】解:A.氧化钙与水的反应生成氢氧化钙,反应为放热反应,氢氧化钙溶解度随着温度升高而降低,故会析出氢氧化钙,溶质质量会变小,然后不变,故A错误; B.加热高锰酸钾的反应生成锰酸钾、二氧化锰和氧气,高锰酸钾完全反应,剩余固体锰酸钾、二氧化锰,质量不能等于0,故B错误;
C.催化剂只能改变化学反应速率,而不影响生成氧气的多少,所以生成的氧气的质量应该相同,只是有催化剂的放出氧气的速率快,故C错误;
D.铜和硝酸银溶液反应生成银和硝酸铜,所以向一定量的硝酸银溶液中插入铜丝溶液的质量会减少,当反应完毕后溶液质量不变,为一定值,故D正确;
故选:D.
【考点精析】解答此题的关键在于理解溶解度、饱和溶液的概念的相关知识,掌握在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫作这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫作不饱和溶液;在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫作这种物质在这种物质在这种溶剂里的溶解度.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。
(1)25℃,1.01×105Pa时,32g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量726.6KJ,该反应的热化学方程式为______________________________________________。
(2)目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=_______________(注明单位);
②用三段式计算H2的转化率____________;
③下列说法中,能说明上述反应达到平衡状态的是_____
A.每消耗1mol CO2的同时生成1mol CH3OH
B. CO2、H2、CH3OH和H2O的物质的量的比为1:3:1:1
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是______
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用高效催化剂 D.恒温恒容再充入1 molCO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于加成反应的是
A. 乙烯使溴水褪色 B. 苯与硝酸反应生成硝基苯
C. 乙烯使酸性KMnO4溶液褪色 D. 甲烷与Cl2混合,光照后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键和化合物的说法不正确的是
A.离子键就是阴阳离子间强烈的静电作用
B.H和Cl形成的分子中存在的是极性共价键
C.氯化铵中没有金属元素,所以不是离子化合物
D.11号与9号元素能够形成离子化合物,该化合物中存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与强酸反应,又能与强碱反应,且都能生成盐和水的是( )
①Al ②Al2O3 ③Al(OH)3 ④Na2CO3
A.①③B.②③④C.②③D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中原因或结论与现象对应的是
选项 | 现象 | 原因或结论 |
A | 将NO2球浸泡在热水中,球中气体颜色加深 | 2NO2(g) △H=-56.9kJ·mol-1,升温平衡向生成NO2方向移动 |
B | 在密闭容器中有反应:A(g)+B(g) | x=l,增大压强平衡正向移动 |
C | 向装有2mL5%H2O2溶液的两只试管中分别滴0.lmol·L-1 FeCl3和CuSO4溶液各lmL,摇匀。滴入 FeCl3溶液产生的气泡更快些 | Fe3+的催化效果比Cu2+的好 |
D | 常温下将铝片放入浓硝酸中无明显现象 | 常温下铝和浓硝酸不反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g) ![]() 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) △H=___________kJ·mol-1。
2NH3(g) △H=___________kJ·mol-1。
(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________;
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)__________;
③若其它条件不变增大压强,则合成氨反应的化学平衡常数____________(填“变大”、“变小或“不变”);
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。

i .X代表的物理量是________________,
ii.判断L1、L2的大小关系____________ (填“>”“ <”或“ = ”),并简述理由:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢分解制取氢气和硫磺的原理为2H2S(g)![]() S2(g)+ 2H2(g),在2.0L恒容密闭容器中充入0.1mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法正确的是
S2(g)+ 2H2(g),在2.0L恒容密闭容器中充入0.1mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法正确的是

A. 正反应是放热反应
B. 图中P点:v(正)> v(逆)
C. 950℃时,0~1.25s内,生成H2 的 平均反应速率为0.016 mol·l-1 ·s-1
D. 950℃时,该反应的平衡常数的值小于3.125×10-4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com