
【题目】为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。
(1)25℃,1.01×105Pa时,32g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量726.6KJ,该反应的热化学方程式为______________________________________________。
(2)目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=_______________(注明单位);
②用三段式计算H2的转化率____________;
③下列说法中,能说明上述反应达到平衡状态的是_____
A.每消耗1mol CO2的同时生成1mol CH3OH
B. CO2、H2、CH3OH和H2O的物质的量的比为1:3:1:1
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是______
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用高效催化剂 D.恒温恒容再充入1 molCO2和3 mol H2
【答案】 CH3OH(l)+![]() O 2(g)=CO2(g)+2H2O(l) △H=-726.6KJ/mol 0.075 mol·(L·min)-1 H2的转化率=2.25/3.0×100% =75% C BD
O 2(g)=CO2(g)+2H2O(l) △H=-726.6KJ/mol 0.075 mol·(L·min)-1 H2的转化率=2.25/3.0×100% =75% C BD
【解析】(1)32g液态甲醇(CH3OH)的物质的量为32g/32g/mol=1mol,)25℃,1.01×105Pa时,水为液态,则反应的热化学方程式为:CH3OH(l)+3/2O 2(g)=CO2(g)+2H2O(l) △H=-726.6KJ/mol;
(2)①根据图象可知生成CH3OH的浓度为0.75mol/L,所以v=△C/ t=0.75mol/L/10min==0.075mol/(Lmin);
②参加反应的二氧化碳的物质的量为0.75mol/L×1L=0.75mol,根据化学方程式可知,参加反应的氢气的物质的量为0.75mol×3=2.25mol,转化率=2.25mol/3mol×100%===75%;
③A.消耗CO2的同时生成CH3OH,都是指的正反应,不能反映出正逆反应速率的关系,故不能说明反应是否处于平衡状态;B.CO2、H2、CH3OH和H2O的物质的量的比与起始加入的量有关与反应是否处于平衡状态无关,故不能说明反应是否处于平衡状态;C.该反应为气体体积减小的反应,即压强也减小的反应,所以当容器中气体的压强不再改变时,就说明反应已经处于平衡状态;D.该反应容器体积不变,反应前后气体质量守恒,所以容器中气体的密度始终不变,所以不能根据密度的变化判断反应是否处于平衡状态;故选C;
④A.该反应为放热反应,升高温度平衡逆向移动,故A错误;B.将CH3OH(g)从体系中分离,即减小生成物浓度,平衡正向移动,故B正确;C.使用高效催化剂对平衡移动没有影响,所以平衡不移动,故C错误; D.恒温恒容再充入1molCO2和3molH2,相当于加压,由于反应是气体体积减小的反应,所以平衡正向移动,故D正确;故选BD;


科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 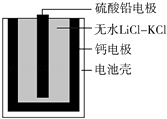
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石中的碳化钙和水能完全反应:CaC2+2H2O=C2H2↑+Ca(OH)2使反应产生的气体排水,测量排出水的体积,可计算出标准状况下乙炔的体积,从而可测定电石中碳化钙的含量。
(1)若用下列仪器和导管组装实验装置

如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是:____接____接____接____接____接____。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不产生气体时,关闭活塞。
正确的操作顺序(用操作编号填写)是__________________。
(3)若实验产生的气体有难闻气味,且测定结果偏大,这是因为电石中含有___________杂质。
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是_________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是
A. K2SO4=2K++SO4-2 B. Ba(OH)2=Ba2++OH2-
C. Mg(NO3)2=Mg2++2(NO3)2- D. Fe2(SO4)3=2Fe3++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能通过一步反应直接完成的是( )
A.Al→Al3+B.Na2SO3→NaOHC.Al2O3→Al(OH)3D.Fe(OH)2→Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法错误的是( )
A.乙酸乙酯中含有18O
B.18O存在于水中
C.此反应属于取代反应
D.生成的乙酸乙酯的相对分子质量为90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象能正确反映对应的实验操作的是( )
A.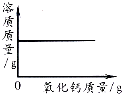 向一定量的饱和石灰水中加入氧化钙
向一定量的饱和石灰水中加入氧化钙
B.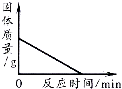 加热一定量高锰酸钾固体产生氧气
加热一定量高锰酸钾固体产生氧气
C.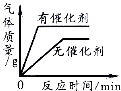 用一定量的双氧水制取氧气
用一定量的双氧水制取氧气
D. 向一定量的硝酸银溶液中插入铜丝
向一定量的硝酸银溶液中插入铜丝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com