
【题目】下列变化不能通过一步反应直接完成的是( )
A.Al→Al3+B.Na2SO3→NaOHC.Al2O3→Al(OH)3D.Fe(OH)2→Fe(OH)3
科目:高中化学 来源: 题型:
【题目】利尿酸在奥运会上被禁用,其结构简式如图所示。下列叙述正确的是( )

A. 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B. 利尿酸分子内处于同一平面的原子不超过10个
C. 1mol利尿酸能与7mol H2发生加成反应
D. 利尿酸能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是
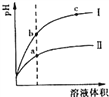
A. Ⅱ为盐酸稀释时的pH值变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。
(1)25℃,1.01×105Pa时,32g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量726.6KJ,该反应的热化学方程式为______________________________________________。
(2)目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=_______________(注明单位);
②用三段式计算H2的转化率____________;
③下列说法中,能说明上述反应达到平衡状态的是_____
A.每消耗1mol CO2的同时生成1mol CH3OH
B. CO2、H2、CH3OH和H2O的物质的量的比为1:3:1:1
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是______
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用高效催化剂 D.恒温恒容再充入1 molCO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液 ![]() 有白色沉淀,说明原溶液中有Cl﹣
有白色沉淀,说明原溶液中有Cl﹣
B.某溶液 ![]() 有白色沉淀,说明原溶液中有SO42﹣
有白色沉淀,说明原溶液中有SO42﹣
C.某溶液 ![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D.某溶液 ![]() 生成无色气体,说明原溶液中有CO32﹣
生成无色气体,说明原溶液中有CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下体积均为2L的两个恒容容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
SO2 | O2 | SO3 | ||
① | 2 | 1 | 0 | 放热 156.8 kJ |
② | 0.6 | 0.3 | 1.4 | Q(Q>0) |
下列叙述不正确的是
A. 容器①中达到平衡吋,O2的转化率为80%
B. Q=19.6kJ
C. 容器①、②中反应的平衡常数相等,K=80
D. 相同温度下,起始时向容器中充入0.8 mol SO2、0.4 mol O2和3.2 mol SO3,反应达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法不正确的是
A. 分别用pH=11的氢氧化钠溶液中和等体积pH=3盐酸和pH=3醋酸溶液至pH=7,所需氢氧化钠溶液的体积前者小于后者
B. 等体积pH=3的盐酸和pH=3醋酸的溶液中分别加入少量相同的锌粒,醋酸中锌粒先反应完
C. 三瓶溶液加水稀释100倍,pH变化最大的是醋酸溶液
D. 三瓶溶液中水电离出的c(H+)均为1.0×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于加成反应的是
A. 乙烯使溴水褪色 B. 苯与硝酸反应生成硝基苯
C. 乙烯使酸性KMnO4溶液褪色 D. 甲烷与Cl2混合,光照后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g) ![]() 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) △H=___________kJ·mol-1。
2NH3(g) △H=___________kJ·mol-1。
(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________;
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)__________;
③若其它条件不变增大压强,则合成氨反应的化学平衡常数____________(填“变大”、“变小或“不变”);
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。

i .X代表的物理量是________________,
ii.判断L1、L2的大小关系____________ (填“>”“ <”或“ = ”),并简述理由:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com