
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。下列说法不正确的是( )
A.还原性:NaN3 > N2
B.若有65 g NaN3参加反应,则生成的N2的物质的量为1.6 mol
C.每转移1 mol电子,可生成标准状况下N2的体积为35.84 L
D.被还原的N与被氧化的N为15 :1
【答案】A
【解析】
NaN3中N元素的平均化合价为-![]() ,其中N元素的化合价由-
,其中N元素的化合价由-![]() 升至0,NaN3是还原剂,N2为氧化产物;KNO3中N元素的化合价为+5价,其中N元素的化合价由+5降至0,KNO3是氧化剂,N2是还原产物;10molNaN3反应转移10mol电子,生成16molN2;据此分析作答。
升至0,NaN3是还原剂,N2为氧化产物;KNO3中N元素的化合价为+5价,其中N元素的化合价由+5降至0,KNO3是氧化剂,N2是还原产物;10molNaN3反应转移10mol电子,生成16molN2;据此分析作答。
A. NaN3中N元素的平均化合价为-![]() ,其中N元素的化合价由-
,其中N元素的化合价由-![]() 升至0,NaN3是还原剂,KNO3中N元素的化合价为+5价,其中N元素的化合价由+5降至0,KNO3是氧化剂,N2是还原产物,根据同一氧化还原反应中还原性:还原剂>还原产物,则还原性:NaN3>N2,A正确;
升至0,NaN3是还原剂,KNO3中N元素的化合价为+5价,其中N元素的化合价由+5降至0,KNO3是氧化剂,N2是还原产物,根据同一氧化还原反应中还原性:还原剂>还原产物,则还原性:NaN3>N2,A正确;
B.根据反应,10molNaN3参加反应生成16molN2,n(NaN3)=![]() =1mol,则6.5gNaN3参加反应生成1.6molN2,B正确;
=1mol,则6.5gNaN3参加反应生成1.6molN2,B正确;
C.根据反应,转移10mol电子生成16molN2,则转移1mol电子生成1.6molN2,生成的N2在标准状况下的体积1.6mol×22.4L/mol=35.84L,C正确;
D.NaN3中N全部被氧化,KNO3中N全部被还原,则被还原的N与被氧化的N之比为2:30=1:15,D错误;
答案选D。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)= 0.4mol·L-1
B.饱和碳酸氢钠溶液中(已知碳酸氢钠溶液呈碱性):c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-12mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。工业上用软锰矿(主要成分是MnO2·MnO,含有少量Fe2O3、Al2O3、SiO2)制备碳酸锰的流程如下:
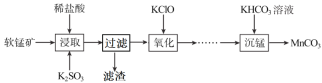
(1)“浸取”步骤中,MnO2·MnO发生反应的离子方程式为___,还能被K2SO3还原的物质有___(填化学式)。“过滤”时滤渣的主要成分是___。
(2)如表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液离子浓度低于1.0×10-5mol·L-1),请补充完整由“氧化”后的溶液制备MnCO3的实验方案:向“氧化”后的溶液中加入____,调pH为___,___,得较纯MnCl2溶液,加入KHCO3溶液沉锰得MnCO3。(实验中可能用到的试剂为K2CO3溶液、盐酸)。
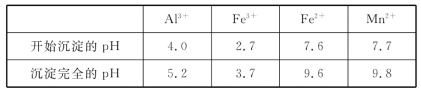
(3)“沉锰”步骤的离子方程式为___,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=___。
(4)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:Mn2++S2O82-+H2O---H++SO42-+MnO4-
①请配平上述离子方程式___;
②确认Mn2+离子已经完全反应的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月13日第26届国际计量大会对国际单位制进行修改。新的摩尔的定义规定,1摩尔物质包括阿伏加德罗常数NA个基本单元。下列有关阿伏加德罗常数NA的说法正确的是( )
A.常温常压下,11gCO2中含有0.75NA个原子
B.2.4g镁变成镁离子时,失去的电子数目为0.1NA
C.标准状况下,NA个水分子的体积约为22.4L
D.1L 0.3mol/L的NaCl溶液中含有0.3NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列转化关系图,且知采用电解熔融氯化钠的方法可以生产金属钠:2NaCl(熔融)![]() 2Na+Cl2↑,下列说法不正确的是( )
2Na+Cl2↑,下列说法不正确的是( )

A.A、C、E一定含有同种元素B.若在B中点燃铜丝会产生棕黄色烟
C.C与D反应会产生红褐色沉淀D.D物质可能为FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.向Ca(
HCO3)
2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com