
【题目】已知下列转化关系图,且知采用电解熔融氯化钠的方法可以生产金属钠:2NaCl(熔融)![]() 2Na+Cl2↑,下列说法不正确的是( )
2Na+Cl2↑,下列说法不正确的是( )

A.A、C、E一定含有同种元素B.若在B中点燃铜丝会产生棕黄色烟
C.C与D反应会产生红褐色沉淀D.D物质可能为FeCl2
【答案】D
【解析】
电解熔融的氯化钠生成Na和Cl2,其中A能与水反应生成C,B能与Fe反应生成D,则A为Na、B为Cl2、D为FeCl3;A与水反应生成的C能与FeCl3反应生成NaCl,C为NaOH;CO2与NaOH反应生成E,FeCl3与Ca(OH)2反应生成F,E与F反应生成NaCl,则E为Na2CO3、F为CaCl2;据此分析作答。
电解熔融的氯化钠生成Na和Cl2,其中A能与水反应生成C,B能与Fe反应![]() 生成D,则A为Na、B为Cl2、D为FeCl3;A与水反应生成的C能与FeCl3反应生成NaCl,C为NaOH;CO2与NaOH反应生成E,FeCl3与Ca(OH)2反应生成F,E与F反应生成NaCl,则E为Na2CO3、F为CaCl2;
生成D,则A为Na、B为Cl2、D为FeCl3;A与水反应生成的C能与FeCl3反应生成NaCl,C为NaOH;CO2与NaOH反应生成E,FeCl3与Ca(OH)2反应生成F,E与F反应生成NaCl,则E为Na2CO3、F为CaCl2;
A.根据上述分析,A、C、E中都含有Na元素,A正确;
B.B为Cl2,铜丝在Cl2中燃烧产生棕黄色的烟,B正确;
C.C为NaOH,D为FeCl3,C与D反应的化学方程式为3NaOH+FeCl3=Fe(OH)3↓+3NaCl,产生红褐色Fe(OH)3沉淀,C正确;
D.由于Cl2具有强氧化性,Fe与Cl2反应生成的D为FeCl3,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】一种从电镍含钴废渣(主要成分有Co(OH)3、Ni(OH)3、Fe(OH)3及少量Ca(OH)2、Mg(OH)2等杂质)中提取氧化钴(Co2O3)的工艺流程如下:
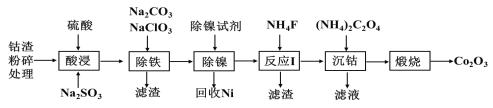
已知:Ksp(CaF2)=3.45×10-11,Ksp(MgF2)=7.42×10-11,Ksp[Co(OH)3]=2×10-44。
(1)在还原剂Na2SO3存在的条件下,钴渣易溶于酸中,请写出酸浸时Co(OH)3与Na2SO3反应的离子方程式______,该步操作中硫酸不宜过量太多的主要原因是 ____。
(2)除铁操作中Fe3+以黄钠铁矾Na2Fe6(SO4)4(OH)12形式从溶液中沉淀析出。中学检验Fe3+的溶液中混有Fe2+的常用试剂是________。
(3)反应Ⅰ中加入NH4F的目的______。
(4)沉钴操作发生的反应为(NH4)2C2O4+CoCl2![]() CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
a.将Na2C2O4溶液与反应Ⅰ滤液同时加入到反应容器中
b.将Na2C2O4溶液缓慢加入到盛有反应Ⅰ滤液的反应容器中
c.将反应Ⅰ滤液缓慢加入到盛有Na2C2O4溶液的反应容器中
(5)450℃在空气中煅烧发生的化学反应方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
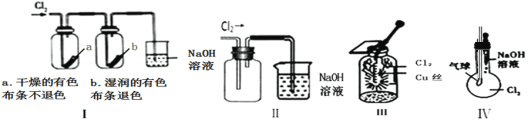
A.图I中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.图II中:收集氯气
C.图IV中:若气球干瘪,证明可与NaOH溶液反应
D.图III中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
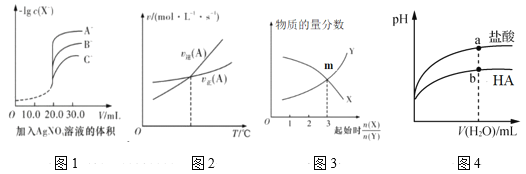
A.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B.图2表示反应中某反应物的正、逆反应速率随温度变化的情况, 由图可知该反应的正反应是吸热反应
C.图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
D.图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸,且a点Kw的数值比b点的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。下列说法不正确的是( )
A.还原性:NaN3 > N2
B.若有65 g NaN3参加反应,则生成的N2的物质的量为1.6 mol
C.每转移1 mol电子,可生成标准状况下N2的体积为35.84 L
D.被还原的N与被氧化的N为15 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成:
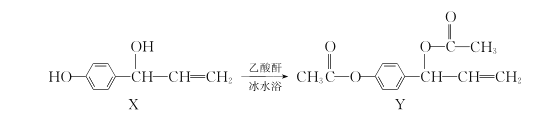
下列说法正确的是
A.Y中有3种不同官能团
B.X、Y分子中均含有的手性碳原子数不相同
C.1molX与溴水充分反应,最多消耗Br2的物质的量为2mol
D.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该溶液中钾离子浓度为:
A.0.1(b-2a)mol/LB.10(b-2a)mol/L
C.10(2a-b)mol/LD.4(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(部分夹持装置略)、试剂和操作方法都正确的是 ( )
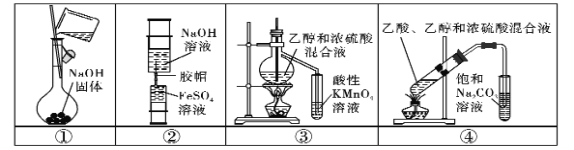
A.用装置①配制250 mL0.1 mol.L-1的NaOH溶液
B.用装置②制备少量Fe(OH)2固体
C.用装置③验证乙烯的生成
D.用装置④制取少量乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵晶体在500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵晶体隔绝空气加热完全分解发生了氧化还原反应,固体产物可能有FeO和Fe2O3 ,气体产物可能有NH3、SO3、H2O、N2和__________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵晶体至分解完全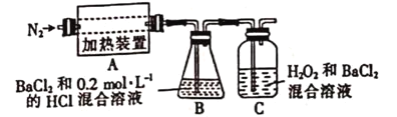
为检验A中残留物是否含有FeO,需要选用的试剂有____________(填标号)。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(3)装置C中有不溶于酸的白色沉淀生成,则C中发生的化学反应的方程式为:____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com