
【题目】有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),原因是_______________。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
【答案】 1s22s22p63s23p2 ![]() N O N原子最外层的电子处于半充满状态,比较稳定 三角锥形 sp3杂化 2 H2O SiH4
N O N原子最外层的电子处于半充满状态,比较稳定 三角锥形 sp3杂化 2 H2O SiH4
【解析】试题分析:本题考查元素的推断,原子核外电子排布式和路易斯结构式的书写,第一电离能的比较,价层电子对互斥理论和杂化方式的判断,π键的确定和元素周期律。A原子最外层p能级的电子数等于次外层的电子总数,A为C元素;A属于第二周期,A、B、C属于同一周期,B原子最外层中有两个不成对的电子,B为O元素;B元素可与A、C、D、E生成RB2型化合物,则C为N元素;DB2中D与B的质量比为7:8,D的相对原子质量为28,D原子核内质子数与中子数相等,D的质子数为14,D为Si元素;EB2中E与B的质量比为1:1,E的相对原子质量为32,E原子核内质子数与中子数相等,E的质子数为16,E为S元素。
(1)D为Si元素,基态Si原子核外有14个电子,根据构造原理,基态硅原子的电子排布式为1s22s22p63s23p2。
(2)AB2为CO2,CO2的电子式为![]() ,结构式为O=C=O,路易斯结构式为
,结构式为O=C=O,路易斯结构式为![]() 。
。
(3)B为O元素,C为N元素,O和N两元素中第一电离能:N![]() O,原因是:N原子的价电子排布为2s22p3,N原子最外层的电子处于半充满状态,比较稳定。
O,原因是:N原子的价电子排布为2s22p3,N原子最外层的电子处于半充满状态,比较稳定。
(4)C的氢化物为NH3,N上的孤电子对数为![]() (5-3
(5-3![]() 1)=1,成键电子对数为3,价层电子对数为4,VSEPR模型为四面体,略去孤电子对,NH3的立体结构为三角锥形。中心原子N的杂化轨道类型为sp3杂化。
1)=1,成键电子对数为3,价层电子对数为4,VSEPR模型为四面体,略去孤电子对,NH3的立体结构为三角锥形。中心原子N的杂化轨道类型为sp3杂化。
(5)C的单质为N2,N2的结构式为N![]() N,三键中含1个σ键和2个π键,N2分子中有2个π键。B为O元素,D为Si元素,非金属性:O
N,三键中含1个σ键和2个π键,N2分子中有2个π键。B为O元素,D为Si元素,非金属性:O![]() Si,B、D两元素的气态氢化物稳定性:H2O
Si,B、D两元素的气态氢化物稳定性:H2O![]() SiH4。
SiH4。


科目:高中化学 来源: 题型:
【题目】下图为有机物M、N、Q的转化关系,有关说法正确的是
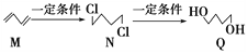
A. M生成N的反应类型是取代反应
B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q
D. 0.3 mol Q与足量金属钠反应生成6.72L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:
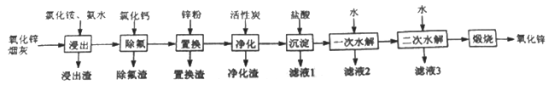
已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn Pb Cu Cl F |
质量分数/% | 59.78 9.07 0.30 2.24 1.80 |
II.“浸出”时,大部分锌元素以Zn(NH3)42+ 形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)Zn的原子序数为30,其在元素周期表中的位置为__________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_______________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol·L-1,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F- 沉淀完全即溶液中c(F-)<10-5 mol·L-1,则所加氯化钙溶液的浓度度最小为_____________。已知:Ksp((CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭的_________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为_________________________________。
(6)将滤液1和滤液2合并,经浓缩后,可返回至__________(填流程中的操作名称)循环利用。
(7)“一次水解”时,产物为Zn(OH)xCly,。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1 g(假设各步均转化完全)。则一次水解产物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为測定某工业碱(组成为xNa2CO3·yNaHCO3)中Na2CO3的貭量分數,甲、乙、丙三名同学分別设计并完成了如下实验:
甲同学:准备称取11.40g样品利用图中装置迸行实验,反应后測定装置C中碱石灰増重5.06g。
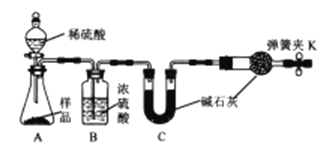
乙同学:准确称取11.40g研细的样品,加热样品至固体完全分解,剩余固体质量为9.54g.
丙同学:准确称取11.40g样品,配成1000mL溶液,量取25.00mL溶液于锥形瓶中,加入指示剂,用0.1500mol/L标准盐酸溶被滴定至终点。完成三次平行实验后,消耗盐酸的体积平均为30.00mL。
(1)如何检查甲同学实验装置的气密性?_______________。
(2)①乙同学需要在______(填仪器名称,下同)将样品研细,在______中加热样品;
②乙同学在实验时需要将固体加热一段时间然后冷却,称量,再加热、冷却、称量,直至最后两次称量的质量差不超过0.10g,其目的是___________ 。
(3)丙同学在实验之前为了确定晶体中是否含有NaHCO3,设计了以下实验方案进行检验。
实验步骤:取少量样品于锥形瓶中加入适量蒸馏水使之溶解,加入几滴酚酞,用0.100mol/L盐酸滴定至溶液由浅红色变无色,记录消耗盐酸的体积为V1;______(填实验操作),记录消耗盐酸的体积为V2,若V2_____V1(填“<、>或=”),说明晶体中含有NaHCO3.
(4)请分析、计算后回答。
①_____同学实验结果错误,其实验失败的原因是___________。
②晶体中Na2CO3的质量分数为____________。(计算结果保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色固体,微溶于水,不溶于乙醇和稀硫酸,在空气中迅速被氧化成绿色;见光则分解,变成褐色;已知CuCl+3Cl-=[CuCl4]3-。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
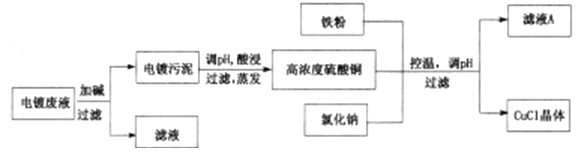
(1)图中的铁粉可以用二氧化硫气体代替,可以减少污染气体的排放,请写出用SO2代替铁粉进行反应的离子方程式:_____________。
(2)常温下形成电镀污泥时,溶液pH=9,已知Ksp[Fe(OH)3]=4×10-38,Ksp[Cu(OH)2]=2×10-20,此时溶液中c(Fe3+):c(Cu2+)=_______。
(3)析出CuCl晶体后,采用过滤的方法进行分离,再对晶体进行洗涤。下列关于洗涤的说法正确的是______(填序号)。
A.因为存在CuCl的沉淀溶解平衡,所以用饱和NaCl溶液洗涤可以降低CuCl的溶解度
B.尽量少用水洗涤,防止其溶解或水解生成CuOH
C.可以用乙醇洗涤使产品快速干燥
D.洗涤时在漏斗中充分搅拌,使杂质尽可能地溶解达到除去的目的
E.如果采用减压过滤,在洗涤时应该先打开阀门与空气相通,再关闭抽气泵,然后再向漏斗中加入洗涤液
(4)第三次过滤的滤液主要成分是_________。
(5)对污泥进行酸浸时的化学反应方程式为___________________。
(6)检验氧化亚铜晶体洗涤干净的操作是_______________。
(7)以粗铜为电极电解一定浓度的氯化钠溶液,控制一定的电压和电流,也可以制得氯化亚铜,写出电解时的阳极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
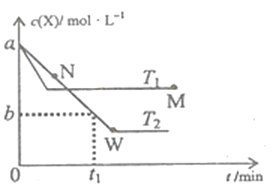
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
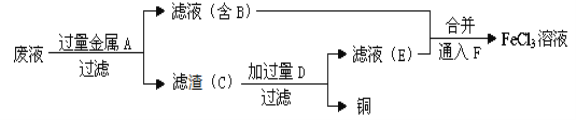
①滤渣C的化学式为_____________。
②通入F发生反应的化学方程式为_________________________。
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
a.加入足量氯水b.加入足量KMnO4溶液 c.加入少量KSCN溶液
A.ac B.cb C.ca D.abc
(2)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备Fe3O4纳米颗粒的反应是:
3Fe2++2S2O32-+O2+xOH- ═Fe3O4↓+S4O62-+2H2O.请回答下列问题.
①水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________.
②反应的化学方程式中x=______.
③每生成1molFe3O4,反应转移的电子为____________mol,被Fe2+还原的O2的物质的量为______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用越来越受到人们的关注。
(1)基态Ti原子核外电子排布的最高能级符号是________。与钛同周期元素中,基态原子的未成对电子数与钛相同的有_______种。
(2)钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是_________
(3)催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。
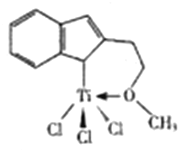
①M中,碳原子的杂化形式有__________种。
②M中,不含___________(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健
(4)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
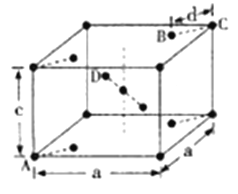
①4个微粒A、B、C、D中,属于氧原子的是______
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,___________,_____________);钛氧键键长d=_________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com