
【题目】CuCl为白色固体,微溶于水,不溶于乙醇和稀硫酸,在空气中迅速被氧化成绿色;见光则分解,变成褐色;已知CuCl+3Cl-=[CuCl4]3-。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
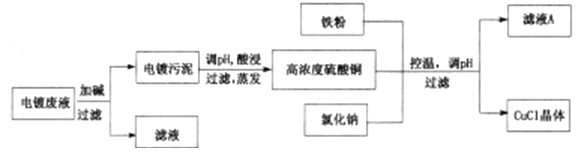
(1)图中的铁粉可以用二氧化硫气体代替,可以减少污染气体的排放,请写出用SO2代替铁粉进行反应的离子方程式:_____________。
(2)常温下形成电镀污泥时,溶液pH=9,已知Ksp[Fe(OH)3]=4×10-38,Ksp[Cu(OH)2]=2×10-20,此时溶液中c(Fe3+):c(Cu2+)=_______。
(3)析出CuCl晶体后,采用过滤的方法进行分离,再对晶体进行洗涤。下列关于洗涤的说法正确的是______(填序号)。
A.因为存在CuCl的沉淀溶解平衡,所以用饱和NaCl溶液洗涤可以降低CuCl的溶解度
B.尽量少用水洗涤,防止其溶解或水解生成CuOH
C.可以用乙醇洗涤使产品快速干燥
D.洗涤时在漏斗中充分搅拌,使杂质尽可能地溶解达到除去的目的
E.如果采用减压过滤,在洗涤时应该先打开阀门与空气相通,再关闭抽气泵,然后再向漏斗中加入洗涤液
(4)第三次过滤的滤液主要成分是_________。
(5)对污泥进行酸浸时的化学反应方程式为___________________。
(6)检验氧化亚铜晶体洗涤干净的操作是_______________。
(7)以粗铜为电极电解一定浓度的氯化钠溶液,控制一定的电压和电流,也可以制得氯化亚铜,写出电解时的阳极反应式:_____________。
【答案】 SO2+2C1-+2Cu2++2H2O=2CuC1↓+SO42-+4H+ 2×10-12 BCE Na2SO4和FeSO4 Cu(OH)2+H2SO4=CuSO4+2H2O 取最后一次洗涤液加入K3[Fe(CN)6],若无蓝色沉淀,则沉淀洗涤干净(或加入氯化钡溶液) Cu-e-+Cl-=CuCl↓
【解析】(1)SO2与硫酸铜及氯化钠溶液反应生成氯化亚铜、硫酸氢钠,反应的离子方程式为SO2+2C1-+2Cu2++2H2O=2CuC1↓+SO42-+4H+;(2)pH=9,c(OH-)=10-5mol/L, Ksp[Fe(OH)3]= c(Fe3+) c3(OH-)=4×10-38,c(Fe3+)=4×10-23 mol/L,Ksp[Cu(OH)2]= c(Cu2+) c2(OH-)=2×10-20,c(Cu2+)=2×10-10 mol/L,此时溶液中c(Fe3+):c(Cu2+)=4×10-23 mol/L:2×10-10 mol/L =2×10-12;(3)A.因为存在CuCl的沉淀溶解平衡,所以用饱和NaCl溶液洗涤可以降低CuCl的溶解度,但会引入杂质氯化钠,选项A错误;B.尽量少用水洗涤,防止其溶解或水解生成CuOH,选项B正确;C.可以用乙醇洗涤使产品中水分带走快速干燥,选项C正确;D.洗涤时在漏斗中不能进行搅拌,应使水顺利流下,选项D错误;E.如果采用减压过滤,在洗涤时应该先打开阀门与空气相通,再关闭抽气泵,然后再向漏斗中加入洗涤液,选项E正确。答案选BCE;(4)铁粉与硫酸铜及氯化钠溶液反应生成氯化亚铜、硫酸亚铁和硫酸钠,第三次过滤的滤液主要成分是Na2SO4和FeSO4;(5)对污泥进行酸浸时是将氢氧化铜溶解生成硫酸钠,反应的化学反应方程式为Cu(OH)2+H2SO4=CuSO4+2H2O;(6)检验氧化亚铜晶体洗涤干净则不含硫酸亚铁,操作是取最后一次洗涤液加入K3[Fe(CN)6],若无蓝色沉淀,则沉淀洗涤干净或取最后一次洗涤液加入氯化钡溶液,若无白色沉淀,则沉淀洗涤干净;(7)电解时阳极铜失电子产生亚铜离子与氯离子反应生成氯化亚铜,电极反应式为:Cu-e-+Cl-=CuCl↓。


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是一种可再生的储氢物质,其产生、储存和应用H2的循环示意图如下。

(1)HCOOH的结构式是________。
(2)产生H2:上图中光催化产生H2的化学方程式是________。
(3)储存H2:
Ⅰ.CO2加氢法:
①已知:2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH =-510 kJ·mol1
2H2 (g) + O2 (g) = 2H2O (l) ΔH =-572 kJ·mol1
则CO2 (g) + H2 (g) = HCOOH (l) ΔH =________。
此反应的化学平衡常数表达式:K=________。
②增大压强,CO2的平衡转化率升高,原因是________。
即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是________。
Ⅱ.电化学还原法:
在碳酸氢盐的水溶液中,CO2还原成甲酸的原理如图1所示。

![]()

![]()
③图1中,阴极的电极反应式是________。
④依据图1,在图2的方框中填出相应物质的化学式或离子符号_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,混合后得到密度为1.17 g·cm-3的溶液。请计算:
①混合后的溶液中NaCl的质量分数为__________________。
②混合后的溶液的物质的量浓度为___________。
③在1 000g水中需加入__________ mol氯化钠,才能使其浓度恰好与上述混合后的溶液的浓度相等(计算结果保留1位小数)。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为__________,混合气体的平均相对分子质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为____________ (计算结果保留1位小数) 。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_______________ (计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,Ⅰ、Ⅱ是两个完全相同的装置,分别装有10 mL相同浓度的盐酸,某学生分别在Ⅰ、Ⅱ的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,然后将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
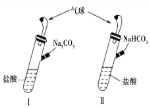
A. 装置Ⅰ的气球膨胀得快
B. 最终两试管中Na+、Cl-的物质的量分别相等
C. 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol·L-1
D. 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),原因是_______________。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)称取一定质量的纯碱溶于水中,与适量的盐酸作用,下列关于盐酸的用量和气体产量的变化是(填偏大、偏小、不变)
①若纯碱中混有K2CO3,盐酸用量将____________;气体产量将_______________。
②若纯碱中混有NaHCO3,盐酸用量将___________;气体产量将_______________。
(2)写出下列离子方程式
①金属钠投入CuSO4溶液_____________________ 。②向饱和食盐水中通入足量氨气和二氧化碳:___________.
(3)向1L,1mol/L的氯化铝溶液中加入含氢氧化钠xmol的氢氧化钠溶液,当铝元素以Al(OH)3和AlO2-形式存在时x的取值范围是_______,当x=3.6时,Al(OH)3的质量为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBiO3可作为测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)来制备,工艺流程如下:
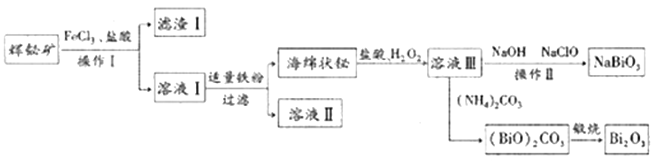
已知:NaBiO3难溶于水。
回答下列问题
(1)溶液Ⅰ中主要成分为BiCl3、FeCl2,则滤渣Ⅰ的主要成分是________(写化学式)。
(2)海绵铋与盐酸、H2O2反应的化学方程式是__________
(3)向溶液Ⅲ中加入NaOH和NaClO发生反应的离于方程式是______,从反应后的混合体系中获得纯净NaBiO3,操作Ⅱ包括_________。
(4)一定温度下,向氨水中通入CO2,得到 (NH4)2CO3、NH4HCO3等物质,溶液中各种微粒的物质的量分数与pH的关系如图所示。随着CO2的通入,溶液中c(OH-)/c(NH3·H2O)将______(填“增大”“减小”或“不变”)。pH=9时,溶液中c(NH4+)+c(H+)=______(用离子浓度表示)。

(5)取所得NaBiO3样品2.0g,加入稀硫酸和MnSO4溶液使其完全溶解,然后用新配制的0.5mol/LFeSO4溶液滴定生成的MnO4-,滴定完成后消耗22.00mLFeSO4溶液。则该样晶中NaBiO3纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既作氧化剂又作还原剂的是( )
A. 2F2+2H2O===4HF+O2 B. 2Na+2H2O===2NaOH+H2↑
C. CaO+H2O===Ca(OH)2 D. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com