
【题目】甲酸(HCOOH)是一种可再生的储氢物质,其产生、储存和应用H2的循环示意图如下。

(1)HCOOH的结构式是________。
(2)产生H2:上图中光催化产生H2的化学方程式是________。
(3)储存H2:
Ⅰ.CO2加氢法:
①已知:2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH =-510 kJ·mol1
2H2 (g) + O2 (g) = 2H2O (l) ΔH =-572 kJ·mol1
则CO2 (g) + H2 (g) = HCOOH (l) ΔH =________。
此反应的化学平衡常数表达式:K=________。
②增大压强,CO2的平衡转化率升高,原因是________。
即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是________。
Ⅱ.电化学还原法:
在碳酸氢盐的水溶液中,CO2还原成甲酸的原理如图1所示。

![]()

![]()
③图1中,阴极的电极反应式是________。
④依据图1,在图2的方框中填出相应物质的化学式或离子符号_____。
【答案】 ![]() 2H2O ==== 2H2↑+ O2↑ -31 kJ·mol1
2H2O ==== 2H2↑+ O2↑ -31 kJ·mol1 ![]() 反应CO2 + H2=HCOOH是气体总分子数减少的反应,增大压强利于反应进行 选择合适的催化剂,增大c(H2) CO2 + H2O +2e-=HCOO-+ OH-
反应CO2 + H2=HCOOH是气体总分子数减少的反应,增大压强利于反应进行 选择合适的催化剂,增大c(H2) CO2 + H2O +2e-=HCOO-+ OH- 
【解析】(1)HCOOH的结构式是![]() ;(2)根据图中信息可知,水催化分解产生O2和H2的化学方程式是2H2O == 2H2↑+ O2↑;(3)①已知反应①2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH1 =-510 kJ·mol1,②2H2 (g) + O2 (g) = 2H2O (l) ΔH2 =-572 kJ·mol1
;(2)根据图中信息可知,水催化分解产生O2和H2的化学方程式是2H2O == 2H2↑+ O2↑;(3)①已知反应①2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH1 =-510 kJ·mol1,②2H2 (g) + O2 (g) = 2H2O (l) ΔH2 =-572 kJ·mol1
,根据盖斯定律,由![]() 得反应CO2 (g) + H2 (g) = HCOOH (l) ΔH =
得反应CO2 (g) + H2 (g) = HCOOH (l) ΔH =![]() ;反应CO2 (g) + H2 (g) = HCOOH (l)的化学平衡常数表达式:K=
;反应CO2 (g) + H2 (g) = HCOOH (l)的化学平衡常数表达式:K=![]() ;②反应CO2 + H2=HCOOH是气体总分子数减少的反应,增大压强利于反应进行,CO2的平衡转化率升高;即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是选择合适的催化剂,增大c(H2);③图1中,阴极上二氧化碳得电子产生HCOO-,电极反应式是CO2 + H2O +2e-=HCOO-+ OH-;④依据图1,在图2中连接正极的阳极上氢氧根离子失电子产生氧气,碳酸氢根离子在左室阴极上得电子产生甲酸故通入的是碳酸氢盐,补充如下图:
;②反应CO2 + H2=HCOOH是气体总分子数减少的反应,增大压强利于反应进行,CO2的平衡转化率升高;即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是选择合适的催化剂,增大c(H2);③图1中,阴极上二氧化碳得电子产生HCOO-,电极反应式是CO2 + H2O +2e-=HCOO-+ OH-;④依据图1,在图2中连接正极的阳极上氢氧根离子失电子产生氧气,碳酸氢根离子在左室阴极上得电子产生甲酸故通入的是碳酸氢盐,补充如下图: 。
。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为__________。氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2)根据等电子体原理,在NO中氮原子轨道杂化类型是__________;1 mol O![]() 中含有的π键数目为__________个。
中含有的π键数目为__________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为__________。
(4)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子?__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
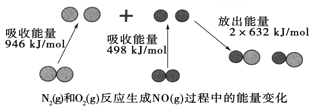
下列说法中正确的是
A. 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)分离胶体和溶液常用的方法叫______________。
(2)除去KNO3溶液中少量杂质AgNO3,可选择加入___________溶液,然后过滤。
(3)已知下列六种物质:熔融KI 、Cl2 、CaCO3固体 、食盐晶体、石墨 、盐酸 ,能导电的电解质是_______________。
(4)100克质量分数46%的酒精(C2H6O)水溶液中含氧原子_________NA。
(5)若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
请完成下列问题:
(1)在上述方程式中用双线桥法标注电子转移情况____________。
(2)浓盐酸在该反应中表现了____________(选填“氧化性”、“还原性”或“酸性”)。
(3)若15.8g KMnO4与足量的浓盐酸充分反应,则有______mol HCl被氧化,产生的Cl2在标准状况下的体积为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为有机物M、N、Q的转化关系,有关说法正确的是
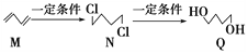
A. M生成N的反应类型是取代反应
B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q
D. 0.3 mol Q与足量金属钠反应生成6.72L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
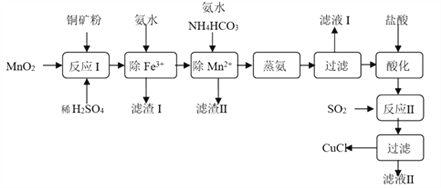
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S + MnO2 + H2SO4 → CuSO4 + S + MnSO4 + H2O(未配平);氧化产物为:__________。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为______________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3![]() [Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )


A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示
B. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者的变化趋势如图b
C. 如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2、3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色固体,微溶于水,不溶于乙醇和稀硫酸,在空气中迅速被氧化成绿色;见光则分解,变成褐色;已知CuCl+3Cl-=[CuCl4]3-。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
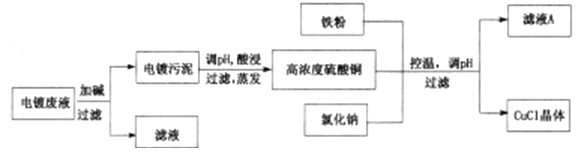
(1)图中的铁粉可以用二氧化硫气体代替,可以减少污染气体的排放,请写出用SO2代替铁粉进行反应的离子方程式:_____________。
(2)常温下形成电镀污泥时,溶液pH=9,已知Ksp[Fe(OH)3]=4×10-38,Ksp[Cu(OH)2]=2×10-20,此时溶液中c(Fe3+):c(Cu2+)=_______。
(3)析出CuCl晶体后,采用过滤的方法进行分离,再对晶体进行洗涤。下列关于洗涤的说法正确的是______(填序号)。
A.因为存在CuCl的沉淀溶解平衡,所以用饱和NaCl溶液洗涤可以降低CuCl的溶解度
B.尽量少用水洗涤,防止其溶解或水解生成CuOH
C.可以用乙醇洗涤使产品快速干燥
D.洗涤时在漏斗中充分搅拌,使杂质尽可能地溶解达到除去的目的
E.如果采用减压过滤,在洗涤时应该先打开阀门与空气相通,再关闭抽气泵,然后再向漏斗中加入洗涤液
(4)第三次过滤的滤液主要成分是_________。
(5)对污泥进行酸浸时的化学反应方程式为___________________。
(6)检验氧化亚铜晶体洗涤干净的操作是_______________。
(7)以粗铜为电极电解一定浓度的氯化钠溶液,控制一定的电压和电流,也可以制得氯化亚铜,写出电解时的阳极反应式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com