
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
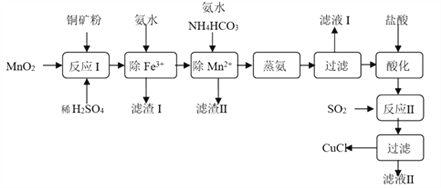
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S + MnO2 + H2SO4 → CuSO4 + S + MnSO4 + H2O(未配平);氧化产物为:__________。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为______________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3![]() [Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
【答案】 CuSO4 S Mn2+ + HCO3-+ NH3·H2O = MnCO3↓+ NH4+ + H2O c 减小压强,平衡逆向移动,利于蒸氨 SO2 +2Cu2+ + 2Cl- + 2H2O = 2 CuCl↓ + SO42- + 4H+ Cu-e-+ Cl- = CuCl↓ b c
【解析】分析:本题以初级铜矿粉为原料制备活性CuCl的流程为载体,考查流程的分析、氧化还原反应的分析、离子方程式的书写、外界条件对化学平衡的影响、电解原理、沉淀的转化。初级铜矿粉主要含Cu2S、CuS、Fe2O3、FeO等,铜矿粉中加入MnO2和稀硫酸,Cu2S、CuS与MnO2、稀硫酸反应生成CuSO4、S、MnSO4和H2O,Fe2O3与稀硫酸反应生成Fe2(SO4)3和H2O,FeO与MnO2、稀硫酸反应生成Fe2(SO4)3、MnSO4和H2O;反应I后加入氨水除去Fe3+;向除Fe3+后的溶液中加入氨水和NH4HCO3除去Mn2+,同时Cu2+转化成[Cu(NH3)4]2+;蒸氨时[Cu(NH3)4]2+先变成Cu(OH)2,Cu(OH)2受热分解成CuO,CuO用盐酸酸化得CuCl2溶液,SO2与CuCl2溶液反应制得CuCl,反应的化学方程式为2CuCl2+SO2+2H2O=2CuCl↓+H2SO4+2HCl。电解制备CuCl时,阳极电极反应式为Cu-e-+Cl-=CuCl↓,阴极电极反应式为2H2O+2e-=H2↑+2OH-。
详解:(1)Cu2S参与反应的化学方程式为:Cu2S+MnO2+H2SO4→CuSO4+S+MnSO4+H2O,在该反应中,Mn元素的化合价由+4价降至+2价,MnSO4为还原产物;Cu元素的化合价由Cu2S中的+1价升至CuSO4中的+2价,S元素的化合价由Cu2S中的-2价升至单质S中的0价,氧化产物为CuSO4和S。
(2)除Mn2+时加入氨水和NH4HCO3得MnCO3沉淀,反应的离子方程式为Mn2++NH3·H2O+HCO3-=MnCO3↓+NH4++H2O。
(3)根据流程,蒸氨时[Cu(NH3)4]2+先变成Cu(OH)2,根据表中信息,c得到的残液颜色为无色透明,说明[Cu(NH3)4]2+转化率很大,蒸氨的条件应选c。选择该条件的原因是:减小压强,平衡Cu(OH)2+4NH3![]() [Cu(NH3)4]2++2OH-逆向移动,利于蒸氨。
[Cu(NH3)4]2++2OH-逆向移动,利于蒸氨。
(4)反应II为向CuCl2溶液中通入SO2制得CuCl,CuCl2被还原成CuCl,SO2被氧化成SO42-,反应的化学方程式为2CuCl2+SO2+2H2O=2CuCl↓+H2SO4+2HCl,反应II的离子方程式为2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+。
(5)①在电解池中阳极发生失电子的氧化反应,根据装置图,阳极Cu失电子生成CuCl,生成CuCl的电极反应式为Cu-e-+Cl-=CuCl↓。
②靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀,淡黄色沉淀可能是CuOH,说明CuOH是黄色或淡黄色固体,不溶于水;电解时阴极电极反应式为2H2O+2e-=H2↑+2OH-,阴极区溶液呈碱性,Ksp(CuCl)=1.2![]() 10-6
10-6![]() Ksp(CuOH)=2
Ksp(CuOH)=2![]() 10-15,CuOH的溶解度小于CuCl,在阴极区CuCl转化为更难溶的CuOH;答案选bc。
10-15,CuOH的溶解度小于CuCl,在阴极区CuCl转化为更难溶的CuOH;答案选bc。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】用“双桥法”表示下列氧化还原反应中电子转移的方向和数目,并指出氧化剂和还原剂。2KClO3 === 2KCl+3O2↑ _______氧化剂_____ 还原剂_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热HCOONa固体,发生的反应有:2HCOONa ![]() Na2C2O4+H2↑ ①
Na2C2O4+H2↑ ①
2HCOONa ![]() Na2CO3 +H2↑+CO↑ ②
Na2CO3 +H2↑+CO↑ ②
Na2C2O4 ![]() Na2CO3 + CO ↑ ③
Na2CO3 + CO ↑ ③
HCOONa加热分解时,固体失重率与温度的关系如右图所示。下列说法正确的是( )

A. T<415℃时,只有反应①发生
B. 反应①、②不可能同时发生
C. 570℃<T<600℃时,残留固体的主要成分是Na2CO3
D. 残留固体中m(Na2C2O4)=m( Na2CO3)时,反应①、②的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是一种可再生的储氢物质,其产生、储存和应用H2的循环示意图如下。

(1)HCOOH的结构式是________。
(2)产生H2:上图中光催化产生H2的化学方程式是________。
(3)储存H2:
Ⅰ.CO2加氢法:
①已知:2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH =-510 kJ·mol1
2H2 (g) + O2 (g) = 2H2O (l) ΔH =-572 kJ·mol1
则CO2 (g) + H2 (g) = HCOOH (l) ΔH =________。
此反应的化学平衡常数表达式:K=________。
②增大压强,CO2的平衡转化率升高,原因是________。
即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是________。
Ⅱ.电化学还原法:
在碳酸氢盐的水溶液中,CO2还原成甲酸的原理如图1所示。

![]()

![]()
③图1中,阴极的电极反应式是________。
④依据图1,在图2的方框中填出相应物质的化学式或离子符号_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为 1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 。
(2)从B分子的立体结构判断,该分子属于 (填“极性”或“非极性”)分子。
(3)C分子中包含 个σ键, 个π键。
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质): 。
Ⅱ.CO的结构可表示为![]() ,N2的结构可表示为
,N2的结构可表示为![]() 。
。
(5)下表是两者的键能数据:(单位:kJ·mol-1)
A—B |
|
| |
CO | 357.7 | 798.9 | 1 071.9 |
N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因: 。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为 ,基态Cu原子的外围电子排布式为 。
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中存在化学平衡:H2(g)+I2(g) ![]() 2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
A. 0.16molL-1 B. 0.08 molL-1 C. 0.04 molL-1 D. 0.02molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述与示意图一致的是:

A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g)ΔH<0;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) ![]() CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
D.图④ 中曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,混合后得到密度为1.17 g·cm-3的溶液。请计算:
①混合后的溶液中NaCl的质量分数为__________________。
②混合后的溶液的物质的量浓度为___________。
③在1 000g水中需加入__________ mol氯化钠,才能使其浓度恰好与上述混合后的溶液的浓度相等(计算结果保留1位小数)。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为__________,混合气体的平均相对分子质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为____________ (计算结果保留1位小数) 。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_______________ (计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)称取一定质量的纯碱溶于水中,与适量的盐酸作用,下列关于盐酸的用量和气体产量的变化是(填偏大、偏小、不变)
①若纯碱中混有K2CO3,盐酸用量将____________;气体产量将_______________。
②若纯碱中混有NaHCO3,盐酸用量将___________;气体产量将_______________。
(2)写出下列离子方程式
①金属钠投入CuSO4溶液_____________________ 。②向饱和食盐水中通入足量氨气和二氧化碳:___________.
(3)向1L,1mol/L的氯化铝溶液中加入含氢氧化钠xmol的氢氧化钠溶液,当铝元素以Al(OH)3和AlO2-形式存在时x的取值范围是_______,当x=3.6时,Al(OH)3的质量为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com