
【题目】在一恒温、恒容的密闭容器中存在化学平衡:H2(g)+I2(g) ![]() 2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
A. 0.16molL-1 B. 0.08 molL-1 C. 0.04 molL-1 D. 0.02molL-1
科目:高中化学 来源: 题型:
【题目】晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1,测知FexO晶体密度ρ=5.71 g·cm-3,晶胞边长为4.28×10-10m。
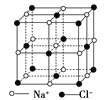
(1)FexO中x值(精确至0.01)为________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为________。
(3)此晶体的化学式为________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何形状是________。
(5)在晶体中,铁离子间最短距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)分离胶体和溶液常用的方法叫______________。
(2)除去KNO3溶液中少量杂质AgNO3,可选择加入___________溶液,然后过滤。
(3)已知下列六种物质:熔融KI 、Cl2 、CaCO3固体 、食盐晶体、石墨 、盐酸 ,能导电的电解质是_______________。
(4)100克质量分数46%的酒精(C2H6O)水溶液中含氧原子_________NA。
(5)若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为有机物M、N、Q的转化关系,有关说法正确的是
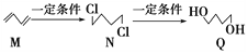
A. M生成N的反应类型是取代反应
B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q
D. 0.3 mol Q与足量金属钠反应生成6.72L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
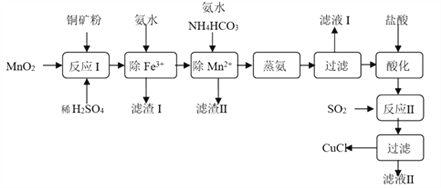
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S + MnO2 + H2SO4 → CuSO4 + S + MnSO4 + H2O(未配平);氧化产物为:__________。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为______________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3![]() [Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然氨基酸M是人体必需的氨基酸之一,其合成路线如下:
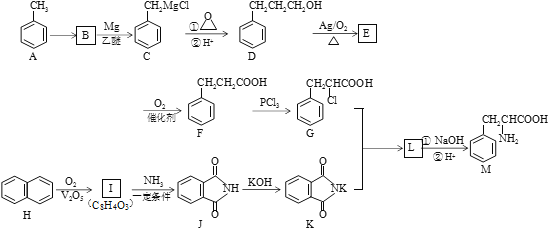
已知: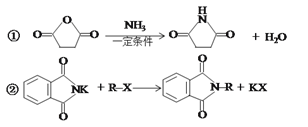
(1)A→B的反应条件和试剂是______________;化合物M的名称为________________;
(2)I→J的反应类型是______________;J分子中最多有_________个原子共平面;
(3)写出D→E反应的化学方程式________________________________________;
(4)I与乙二醇反应可生成能降解的高分子化合物N,写出该反应的化学方程式___________;
(5)符合下列条件的化合物M的同分异构体共有__________种(不考虑立体异构);
①含有苯甲酸结构 ②含有一个甲基 ③苯环上只有两个取代基
其中核磁共振氢谱峰面积比为1:1:2:2:2:3的分子的结构简式________________(任写一种);
(6)请结合以上合成路线,写出以丙酸和上述流程中出现的物质为原料经三步合成丙氨酸(![]() )的路线。____________________________________________________
)的路线。____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )


A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示
B. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者的变化趋势如图b
C. 如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2、3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:
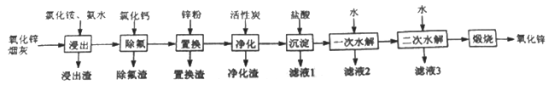
已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn Pb Cu Cl F |
质量分数/% | 59.78 9.07 0.30 2.24 1.80 |
II.“浸出”时,大部分锌元素以Zn(NH3)42+ 形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)Zn的原子序数为30,其在元素周期表中的位置为__________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_______________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol·L-1,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F- 沉淀完全即溶液中c(F-)<10-5 mol·L-1,则所加氯化钙溶液的浓度度最小为_____________。已知:Ksp((CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭的_________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为_________________________________。
(6)将滤液1和滤液2合并,经浓缩后,可返回至__________(填流程中的操作名称)循环利用。
(7)“一次水解”时,产物为Zn(OH)xCly,。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1 g(假设各步均转化完全)。则一次水解产物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
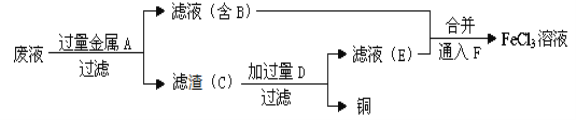
①滤渣C的化学式为_____________。
②通入F发生反应的化学方程式为_________________________。
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
a.加入足量氯水b.加入足量KMnO4溶液 c.加入少量KSCN溶液
A.ac B.cb C.ca D.abc
(2)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备Fe3O4纳米颗粒的反应是:
3Fe2++2S2O32-+O2+xOH- ═Fe3O4↓+S4O62-+2H2O.请回答下列问题.
①水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________.
②反应的化学方程式中x=______.
③每生成1molFe3O4,反应转移的电子为____________mol,被Fe2+还原的O2的物质的量为______mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com