
【题目】下列各反应所对应的方程式正确的是( )
A. Cl2与H2O反应:Cl2+H2O===Cl-+2H++ClO-
B. 向NaNO2溶液中滴加酸性KMnO4溶液:5NO+2MnO+3H2O===5NO+2Mn2++6OH-
C. 向NaHSO4溶液中加入Ba(OH)2溶液至SO![]() 刚好沉淀:H++SO
刚好沉淀:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
D. 向Ba(OH)2溶液中加入硫酸:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
【答案】C
【解析】本题考查离子方程式的正误判断。
解析:次氯酸是弱酸,不能拆成离子,Cl2与H2O反应的离子方程式是:Cl2+H2O=H++Cl-+HClO,A错误;酸性条件下,有H+离子参加反应,不能有OH-离子生成,应该生成水,反应的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O,故B错误;向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至SO42-沉淀完全,需满足二者物质的量之比为1:1,反应的离子方程式为:H++SO42-+
Ba2++OH-═BaSO4↓+H2O,C正确;向Ba(OH)2溶液中滴加稀硫酸时,同时发生中和反应和沉淀反应,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误。


科目:高中化学 来源: 题型:
【题目】一定质量的某有机物与足量金属钠反应,可得VAL气体。相同质量的该有机物与适量的碳酸钠浓溶液反应,可得VBL气体。已知在同温、同压下VA和VB不相同,则该有机物可能是( )
A.CH2=CHCOOH
B.HOOC—COOH
C.CH3CH2COOH
D.HOOCCH2CH(OH)CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学。请根据你所学过的化学知识,判断下列说法中错误的是
A.医疗上常用体积分数为70%~75%的酒精作消毒剂
B.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒
C.海鲜、肉类等食品用福尔马林浸泡防腐保鲜
D.碘沾在手上立即用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500℃和催化剂存在的条件下,某固定容积的容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)。下列有关说法正确的是( )
2SO3(g)(正反应放热)。下列有关说法正确的是( )
A. 达到化学平衡时,混合气体中SO3的质量分数不再变化
B. 在上述条件下,SO2能完全转化为SO3
C. 达到化学平衡时,正反应和逆反应的速率相等且都为零
D. 达到平衡时,SO2和SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
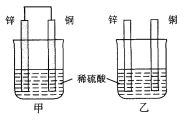
A. 两烧杯中铜片表面均无气泡产生
B. 甲、乙两装置均将化学能转变为电能
C. 两烧杯中溶液均变蓝色
D. 一段时间后,两烧杯中溶液的c(H+)均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2和O2反应生成2molSO3时,放出的热量为QKJ,在1L的密闭容器中进行反应 2SO2(g)+O2(g)![]() 2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是
2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是
A. 反应达到平衡时放出的热量为0.1QKJ
B. 某时刻,SO3的物质的量为0.28 mol,则SO2的转化率为40%
C. 某时刻,SO2、O2、SO3的物质的量分别为0.3mol、0.15mol、0.15mol
D. 某时刻,SO3的浓度可能为0.4mol-1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
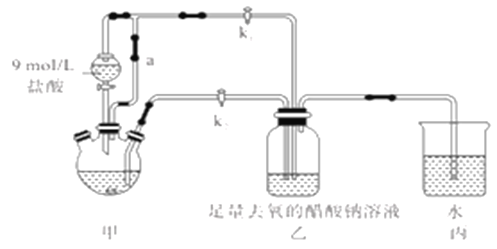
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)生成红棕色晶体的离子反应方程式____________________________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚 ②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氧气氧化某浓度Fe2+为Fe3+过程的实验结果,下列有关说法正确的是
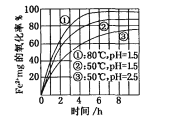
A. pH=1.5时氧化率一定比pH=2.5时大
B. 其他条件相同时,80℃的氧化率比50℃大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为______________________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4 h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4 h后红纸褪色 |
已知,溶液中Cl2、HClO和ClO-物质的量分数(α)随溶液pH变化的关系如下图所示:
![]()

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol e-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com