
【题目】下列实验操作和现象与结论对应关系正确的是![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 测量等浓度的 |
|
|
B | 将 | 溴水褪色 |
|
C | 取少量的变质 | 酸性高锰酸钾溶液褪色 |
|
D | 向苯酚的苯溶液中加入足量NaOH溶液,振荡静置 | 分层 | 上层为苯,下层为NaOH与苯酚钠的混合溶液 |
A.AB.BC.CD.
科目:高中化学 来源: 题型:
【题目】关于下列四种金属堆积模型的说法正确的是( )
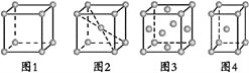
A.图1和图4为非密置层堆积,图2和图3为密置层堆积
B.图1~图4分别是简单立方堆积、体心立方堆积、面心立方堆积、体心立方堆积
C.图1~图4每个晶胞所含有原子数分别为1、2、2、4
D.图1~图4堆积方式的空间利用率分别为52%、68%、74%、74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
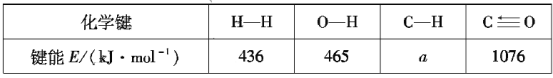
根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
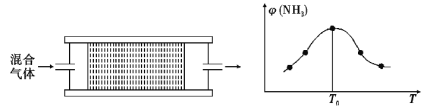
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A可以发生下列过程所示的变化:
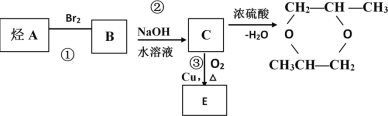
(1)烃A的结构简式是____________;
(2)反应①属_____________反应;
(3)反应②的化学方程式是________,属______反应;反应③的化学方程式是______,属_______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是

A. 该反应属于化合反应
B. b的二氯代物有6种结构
C. 1mol b加氢生成饱和烃需要6molH2
D. C5H11Cl的结构有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
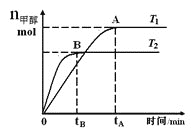
A.平衡常数K=![]()
B.该反应在T1时的平衡常数比T2时的小
C.CO合成甲醇的反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是我国药学家屠呦呦在1971年发现的一种含有过氧基团的倍半萜内酯的无色针状晶体,不溶于水,易溶于乙醇、石油醚、苯等有机溶剂,熔点为156℃,沸点389.9℃,热稳定性差。一种超声提取青蒿素的主要工艺流程如图:
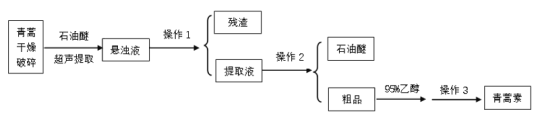
已知:石油醚的沸点为30~80℃,青蒿素在95%乙醇中的溶解度随温度的升高而增大。下列说法不正确的是( )
A.超声提取的原理是在强大的超声波作用下,使青蒿细胞乳化、击碎、扩散,其优点是加速溶解
B.操作1的名称是萃取
C.操作3的步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.操作3中若温度过高,会降低青蒿素的产率,其原因可能是青蒿素热稳定性差
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com