
【题目】反应A(g)+2B(g)=C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是
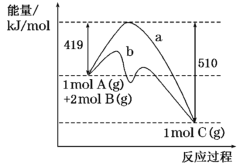
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.曲线b表示使用催化剂后的能量变化
D.该反应的焓变![]() H= -510 kJ·mol-1
H= -510 kJ·mol-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验装置(夹持和尾气处理装置已省略)进行的相应实验,能达到实验目的的是( )
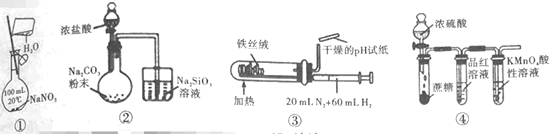
A.利用①装置,配制一定物质的量浓度的NaNO3溶液
B.利用②装置,验证元素的非金属性:Cl>C>Si
C.利用③装置,合成氨并检验氨的生成
D.利用④装置,验证浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),2min末反应达到平衡状态,此时测得D、C的浓度均为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,此时测得D、C的浓度均为0.4mol/L,请填写下列空白:
(1)x值等于_____________。
(2)A的转化率为_______________。
(3)生成D的反应速率为_____________。
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 _________(增大、减小或不变)。
(5)在此温度下,该化学反应的平衡常数k=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,101kPa时测得4.6g乙醇在足量O2中完全燃烧,放出136.68kJ的热量,该反应的热化学方程式正确的是
A.C2H5OH(l)+2O2(g) = 2CO(g)+3H2O(l) ΔH=-1366.8 kJmol-1
B.C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) ΔH=-1366.8 kJmol-1
C.C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(g) ΔH=-136.68 kJmol-1
D.C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) ΔH=1366.8 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲使用 500 mL 0.2 molL -1 CuSO4 溶液,配制该溶液包含以下步骤:
①称取一定质量胆矾(CuSO45H2O)、放入烧杯,用适量蒸馏水将其完全溶解;
②把溶液小心地注入容量瓶中;
③继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm 时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3 次,每次洗涤液都转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞好,充分摇匀。
请填写下列空白:
(1)应该称取胆矾的质量是_________。
(2)上述操作的正确顺序是_________。
(3)实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒__________等,玻璃棒的作用是_________。
(4)下列情况中会导致所配溶液浓度偏小的是 _________(填序号)。
a.容量瓶使用前未干燥
b.转移溶液后,烧杯没有洗涤
c.定容过程观察容量瓶内液面时,俯视刻度线
d.颠倒摇匀后,发现液面低于刻度线,不作任何处置
e.加蒸馏水时不慎超过刻度线,用胶头滴管小心地吸去超出部分,使凹液面底部与刻度线相切
(5)取 100 mL 所配溶液,向其中加入 1.68 g 铁粉,充分反应后,过滤,将固体洗涤、干燥后,再加入 1 molL-1 稀硫酸至固体不再溶解。试计算:
①至少需要稀硫酸 _________mL。
②固体溶解过程中产生氢气_________mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系的表述中,正确的是
A. 0.1 mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 中和pH和体积都相同的硝酸和醋酸溶液,消耗NaOH的物质的量之比为1∶1
C. 0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(H2CO3)
)>c(H2CO3)
D. pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的﹣1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题:
(1)B元素在元素周期表中的位置是第______周期______族;
(2)画出C元素的原子结构示意图______;
(3)与E的氢化物分子所含电子总数相等的分子是______(举一例,填化学式,下同)、阳离子是______;
(4)A与D形成的化合物中含有化学键的类型是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,Mg(OH)2的溶度积常数表达式Ksp=_____。
(2)MgCl2溶液显酸性,其水解的离子方程式为_____。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有______
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中直接加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出生成Mg(OH)Cl的化学方程式______。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是______。
(6)如果直接电解MgCl2溶液,将得不到金属镁,写出该电解反应方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质] 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用。
(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中1/3的Cu以罕见的Cu3+形式存在。Cu在元素周期表中的位置为_______,基态Cu3+的核外电子排布式为____________。
(2)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合作录音磁带磁粉原料的为____(填选项字母)。
A.V2O5 B.CrO2 C.PbO D.ZnO
(3)屠呦呦因在抗疟药——青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人。青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为___________;碳原子的杂化方式有_______。
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示。
①“可燃冰”中分子间存在的2种作用力为________________。
②H2O的VSEPR模型为___________,比较键角的大小:H2O_______CH4(填“>”“<”或“=”),原因为___________________________________。
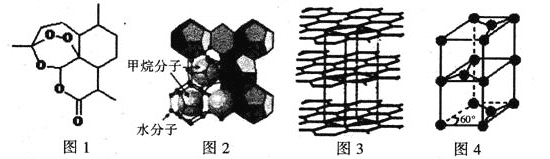
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景,该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有__________个碳原子。已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为_________________g·cm-3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com