
【题目】[化学—选修3:物质结构与性质] 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用。
(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中1/3的Cu以罕见的Cu3+形式存在。Cu在元素周期表中的位置为_______,基态Cu3+的核外电子排布式为____________。
(2)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合作录音磁带磁粉原料的为____(填选项字母)。
A.V2O5 B.CrO2 C.PbO D.ZnO
(3)屠呦呦因在抗疟药——青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人。青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为___________;碳原子的杂化方式有_______。
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示。
①“可燃冰”中分子间存在的2种作用力为________________。
②H2O的VSEPR模型为___________,比较键角的大小:H2O_______CH4(填“>”“<”或“=”),原因为___________________________________。
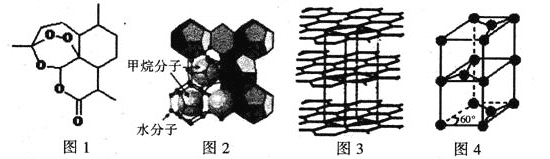
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景,该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有__________个碳原子。已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为_________________g·cm-3(列出计算式)。
【答案】第四周期第I B族 [Ar] 3d8 B O>C>H sp2、sp3 氢键、范德华力 四面体形 < 甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小 4 ![]() 或
或![]() 或
或![]()
【解析】
(1)据元素周期表得,铜在周期表中位于:第四周期第ⅠB族;铜是29号元素故Cu3+的核外电子排布式为:[Ar] 3d8;
(2)四价Cr核外有未成对电子故有磁性,答案选B;
(3)由图1得,组成元素是CHO三种元素,故其电负性由大到小的顺序为:O>C>H;其中碳原子存在双键和单键故为sp2、sp3杂化;
(4)①可燃冰中存在水,故有氢键,分子之间存在范德华力;②水分子中价层电子对个数=2+![]() ×(6-2×1)=4且含有2个孤电子对,所以其空间构型为四面体结构;甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小,故H2O<CH4;
×(6-2×1)=4且含有2个孤电子对,所以其空间构型为四面体结构;甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小,故H2O<CH4;
(5)中间四个顶点代表的原子被四个相邻的晶胞所共享,这样每个晶胞中只分摊到0.25个原子,一个晶胞中含有碳原子数=0.25×4=1,上层和下层八个顶点各属于八个晶胞每个晶胞只分摊到![]() ,一个晶胞中含有碳原子数=
,一个晶胞中含有碳原子数=![]() ×8=1,体心上一个,上下面上各占半个共1个,故一个晶胞中含有碳原子数4个碳原子;密度=质量/体积=
×8=1,体心上一个,上下面上各占半个共1个,故一个晶胞中含有碳原子数4个碳原子;密度=质量/体积=![]() =
=![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】反应A(g)+2B(g)=C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是
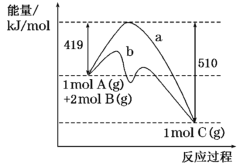
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.曲线b表示使用催化剂后的能量变化
D.该反应的焓变![]() H= -510 kJ·mol-1
H= -510 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在体积为2L的密闭容器中,气态物质A、B、E、F的物质的量n随时间t的变化情况如图甲所示,在一定条件下反应达到平衡状态,反应进程中正反应速率随时间的变化情况如图乙所示,在![]() 、
、![]() 时刻分别只改变一个条件
时刻分别只改变一个条件![]() 温度、压强或某反应物的量
温度、压强或某反应物的量![]() 。下列说法错误的是
。下列说法错误的是
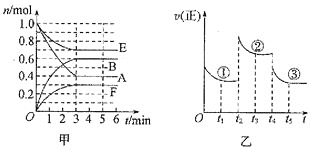
A.此温度下,该反应的化学方程式为![]()
B.若平衡状态![]() 和
和![]() 对应的温度相同,则
对应的温度相同,则![]() 和
和![]() 对应的平衡常数K一定相同
对应的平衡常数K一定相同
C.![]() 时刻改变的条件是增大压强
时刻改变的条件是增大压强
D.![]() 时刻改变的条件是降低温度
时刻改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.二氧化氯是高效、低毒的消毒剂。已知:![]() 是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)![]() 的制备及性质探究装置如图:
的制备及性质探究装置如图:
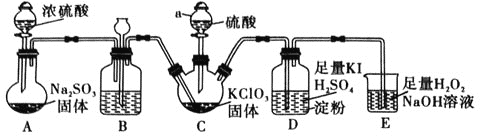
①仪器a的名称为________,装置B的作用是________。
②装置C用于制备![]() ,同时还生成一种酸式盐,该反应的化学方程式为________________。装置D的作用是________________。
,同时还生成一种酸式盐,该反应的化学方程式为________________。装置D的作用是________________。
③![]() 可用于处理碱性含硫废水
可用于处理碱性含硫废水![]() 硫被氧化为最高价态
硫被氧化为最高价态![]() ,
,![]() 与
与![]() 溶液反应的离子方程式为________________________。
溶液反应的离子方程式为________________________。
④装置E用于吸收尾气,反应可得![]() 溶液。已知
溶液。已知![]() 饱和溶液在温度低于
饱和溶液在温度低于![]() 时析出的晶体是
时析出的晶体是![]() ,在温度高于
,在温度高于![]() 时析出的晶体是
时析出的晶体是![]() 。请补充从
。请补充从![]() 溶液中制得
溶液中制得![]() 晶体的操作步骤:
晶体的操作步骤:
![]() ________________________;
________________________;
![]() ________________;
________________;
![]() 洗涤;
洗涤;
![]() 干燥。
干燥。
(2)测定生成![]() 的质量
的质量
实验步骤如下:
![]() 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤装置
取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤装置![]() 次,并将洗涤液一并转移到容量瓶中,加蒸馏水稀释至刻度。
次,并将洗涤液一并转移到容量瓶中,加蒸馏水稀释至刻度。
![]() 从容量瓶中取出
从容量瓶中取出![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 硫代硫酸钠标准溶液滴定
硫代硫酸钠标准溶液滴定![]() ,指示剂显示终点时消耗硫代硫酸钠溶液
,指示剂显示终点时消耗硫代硫酸钠溶液![]() 。
。
![]() 滴定至终点的现象是________________________。
滴定至终点的现象是________________________。
![]() 进入装置D中的
进入装置D中的![]() 的质量为________________。
的质量为________________。
![]() 若滴定开始仰视读数,滴定终点时正确读数,则测定结果________
若滴定开始仰视读数,滴定终点时正确读数,则测定结果________![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·L-1,C能发生银镜反应,F为有浓郁香味、不易溶于水的油状液体。
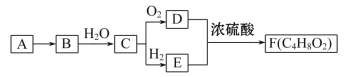
请回答:
(1)有机物D中含有的官能团名称是________;有机物B的结构简式是________。
(2)C→D的反应方程式是________________________________。
(3)C→E的反应类型是____________
A、加成反应 B、取代反应 C、氧化反应 D、还原反应
(4)下列说法正确的是________。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() △H=+802kJ/mol,如图为在恒温、光照、不同初始浓度和不同催化剂
△H=+802kJ/mol,如图为在恒温、光照、不同初始浓度和不同催化剂![]() Ⅰ、Ⅱ
Ⅰ、Ⅱ![]() 作用下,体积为2L的密闭容器中
作用下,体积为2L的密闭容器中![]() 随光照时间的变化曲线。根据所给信息可得出的结论
随光照时间的变化曲线。根据所给信息可得出的结论

A.对于Ⅰ,![]() ,υ(H2O)=0.015mol mol·L-1·h-1
,υ(H2O)=0.015mol mol·L-1·h-1
B.![]() ,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
C.![]() ,使用催化剂Ⅰ吸出的热量多于催化剂Ⅱ
,使用催化剂Ⅰ吸出的热量多于催化剂Ⅱ
D.a点时,二氧化碳的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为2L的恒容密闭容器中,充入8 mol A和4 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(s)+D(g),2 min达平衡,测得生成3.2mol C,下列说法正确的是
4C(s)+D(g),2 min达平衡,测得生成3.2mol C,下列说法正确的是
A.前2 min,D的平均反应速率为0.4 mol·L-1·min-1
B.B的平衡转化率是40%
C.其他条件不变,增大该体系的压强,平衡不移动
D.其他条件不变,向平衡体系中充入B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①RNH2+R’CH2Cl![]() RNHCH2R’+HCl(R和R’代表烃基)
RNHCH2R’+HCl(R和R’代表烃基)
②苯的同系物能被高锰酸钾氧化,如:![]()
![]()
![]()
③![]()
![]()
![]() (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
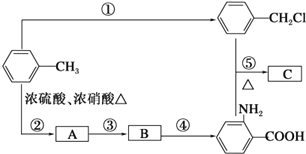
请回答下列问题:
(1)B物质的结构简式是 ______。
(2)写出反应①、②的化学方程式:
①______________;
②______________。
(3)反应①~⑤中,属于取代反应的是______(填反应序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
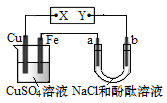
A.X是负极,Y是正极
B.CuSO4溶液的pH减小
C.a极产生的气体能使湿润的红色石蕊试纸先变红后褪色
D.若电路中转移了0.02 mol e-,Fe电极增重0.64g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com