
【题目】.二氧化氯是高效、低毒的消毒剂。已知:![]() 是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)![]() 的制备及性质探究装置如图:
的制备及性质探究装置如图:
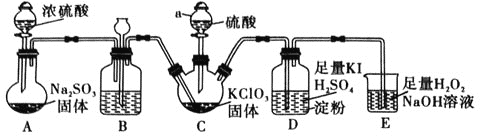
①仪器a的名称为________,装置B的作用是________。
②装置C用于制备![]() ,同时还生成一种酸式盐,该反应的化学方程式为________________。装置D的作用是________________。
,同时还生成一种酸式盐,该反应的化学方程式为________________。装置D的作用是________________。
③![]() 可用于处理碱性含硫废水
可用于处理碱性含硫废水![]() 硫被氧化为最高价态
硫被氧化为最高价态![]() ,
,![]() 与
与![]() 溶液反应的离子方程式为________________________。
溶液反应的离子方程式为________________________。
④装置E用于吸收尾气,反应可得![]() 溶液。已知
溶液。已知![]() 饱和溶液在温度低于
饱和溶液在温度低于![]() 时析出的晶体是
时析出的晶体是![]() ,在温度高于
,在温度高于![]() 时析出的晶体是
时析出的晶体是![]() 。请补充从
。请补充从![]() 溶液中制得
溶液中制得![]() 晶体的操作步骤:
晶体的操作步骤:
![]() ________________________;
________________________;
![]() ________________;
________________;
![]() 洗涤;
洗涤;
![]() 干燥。
干燥。
(2)测定生成![]() 的质量
的质量
实验步骤如下:
![]() 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤装置
取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤装置![]() 次,并将洗涤液一并转移到容量瓶中,加蒸馏水稀释至刻度。
次,并将洗涤液一并转移到容量瓶中,加蒸馏水稀释至刻度。
![]() 从容量瓶中取出
从容量瓶中取出![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 硫代硫酸钠标准溶液滴定
硫代硫酸钠标准溶液滴定![]() ,指示剂显示终点时消耗硫代硫酸钠溶液
,指示剂显示终点时消耗硫代硫酸钠溶液![]() 。
。
![]() 滴定至终点的现象是________________________。
滴定至终点的现象是________________________。
![]() 进入装置D中的
进入装置D中的![]() 的质量为________________。
的质量为________________。
![]() 若滴定开始仰视读数,滴定终点时正确读数,则测定结果________
若滴定开始仰视读数,滴定终点时正确读数,则测定结果________![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() 。
。
【答案】分液漏斗 安全瓶![]() 或防堵塞
或防堵塞![]()
![]() 检验有
检验有![]() 生成,进而证明
生成,进而证明![]() 具有强氧化性
具有强氧化性 ![]() 加热浓缩,冷却至
加热浓缩,冷却至![]() 以上结晶 趁热过滤 溶液由蓝色变为无色,且半分钟内不恢复原色
以上结晶 趁热过滤 溶液由蓝色变为无色,且半分钟内不恢复原色 ![]() 偏低
偏低
【解析】
(1)浓硫酸和亚硫酸钠反应生成二氧化硫, A制备二氧化硫, B装置有缓冲作用,能防止倒吸、堵塞;装置 C用于制备![]() ,同时还生成一种酸式盐,则 C中发生反应
,同时还生成一种酸式盐,则 C中发生反应![]() ,
,![]() 是一种黄绿色易溶于水的气体,具有强氧化性,所以 D中发生氧化还原反应生成碘,装置 D中滴有几滴淀粉溶液,碘遇淀粉变蓝色;装置 E用于吸收尾气,反应生成
是一种黄绿色易溶于水的气体,具有强氧化性,所以 D中发生氧化还原反应生成碘,装置 D中滴有几滴淀粉溶液,碘遇淀粉变蓝色;装置 E用于吸收尾气,反应生成![]() ,双氧水作还原剂生成氧气,从而防止尾气污染环境,据此分析解题;
,双氧水作还原剂生成氧气,从而防止尾气污染环境,据此分析解题;
(2)①淀粉遇碘变蓝,当终点时碘消耗完则蓝色消失;
②根据ClO2溶液与碘化钾反应的离子方程中计量关系进行计算解答;
③根据c待V待=c标V标,则c待=![]() 进行分析;
进行分析;
(1)![]() 仪器 a的名称为分液漏斗,装置 B有缓冲作用,所以能防倒吸、防堵塞
仪器 a的名称为分液漏斗,装置 B有缓冲作用,所以能防倒吸、防堵塞![]() 或平衡气压、安全瓶均可
或平衡气压、安全瓶均可![]() ;
;
![]() 装置 C用于制备
装置 C用于制备![]() ,同时还生成一种酸式盐,根据元素守恒知,生成的酸式盐为硫酸氢钠,该反应的化学方程式为
,同时还生成一种酸式盐,根据元素守恒知,生成的酸式盐为硫酸氢钠,该反应的化学方程式为![]() ;装置 D中滴有几滴淀粉溶液,淀粉遇碘变蓝色,根据淀粉是否变色来判断是否有碘生成,从而证明二氧化氯是否具有氧化性,
;装置 D中滴有几滴淀粉溶液,淀粉遇碘变蓝色,根据淀粉是否变色来判断是否有碘生成,从而证明二氧化氯是否具有氧化性,
![]() 与
与![]() 溶液反应的离子方程式为
溶液反应的离子方程式为![]() ;
;
![]() 装置 E用于吸收尾气,反应生成
装置 E用于吸收尾气,反应生成![]() ,从
,从![]() 溶液中制得
溶液中制得![]() 晶体的操作步骤:加热浓缩,冷却至
晶体的操作步骤:加热浓缩,冷却至![]() 以上结晶;趁热过滤;洗涤;干燥;
以上结晶;趁热过滤;洗涤;干燥;
(2)![]() 碘单质与淀粉变蓝色,所以滴定终点现象为溶液由蓝色变为无色,且半分钟内不恢复原色;
碘单质与淀粉变蓝色,所以滴定终点现象为溶液由蓝色变为无色,且半分钟内不恢复原色;
![]() ,
,![]() ,根据
,根据![]() ,
,![]() ,
,![]() ;
;
![]() 若滴定开始仰视读数,滴定终点时正确读数,则消耗标准液体积偏小,根据c待=
若滴定开始仰视读数,滴定终点时正确读数,则消耗标准液体积偏小,根据c待=![]() ,测定结果偏低。
,测定结果偏低。


科目:高中化学 来源: 题型:
【题目】25℃,101kPa时测得4.6g乙醇在足量O2中完全燃烧,放出136.68kJ的热量,该反应的热化学方程式正确的是
A.C2H5OH(l)+2O2(g) = 2CO(g)+3H2O(l) ΔH=-1366.8 kJmol-1
B.C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) ΔH=-1366.8 kJmol-1
C.C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(g) ΔH=-136.68 kJmol-1
D.C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) ΔH=1366.8 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,Mg(OH)2的溶度积常数表达式Ksp=_____。
(2)MgCl2溶液显酸性,其水解的离子方程式为_____。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有______
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中直接加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出生成Mg(OH)Cl的化学方程式______。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是______。
(6)如果直接电解MgCl2溶液,将得不到金属镁,写出该电解反应方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】模拟电渗析法淡化海水的工作原理示意图如下。已知X、Y均为惰性电极,模拟海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子。下列叙述不正确的是( )
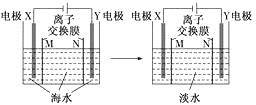
A.N是阴离子交换膜
B.Y电极上产生有色气体
C.X电极区域有浑浊产生
D.X电极反应式为2H2O-4e-=4H++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 表示中子数为10的氧元素的一种核素
表示中子数为10的氧元素的一种核素
B.金刚石和石墨互为同素异形体,两者之间不能相互转化
C.CH3COOH和CH3COOCH3互为同系物
D.C6H14的同分异构体有4种,其熔点各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下列判断不正确的是
![]()
A. 最高正化合价:X<Y<Z
B. 原子半径:X<Y<Z
C. 气态氢化物的热稳定性:Z<W
D. 最高价氧化物对应水化物的酸性:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质] 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用。
(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中1/3的Cu以罕见的Cu3+形式存在。Cu在元素周期表中的位置为_______,基态Cu3+的核外电子排布式为____________。
(2)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合作录音磁带磁粉原料的为____(填选项字母)。
A.V2O5 B.CrO2 C.PbO D.ZnO
(3)屠呦呦因在抗疟药——青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人。青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为___________;碳原子的杂化方式有_______。
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示。
①“可燃冰”中分子间存在的2种作用力为________________。
②H2O的VSEPR模型为___________,比较键角的大小:H2O_______CH4(填“>”“<”或“=”),原因为___________________________________。
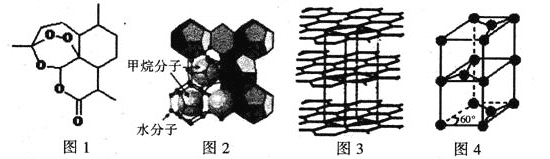
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景,该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有__________个碳原子。已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为_________________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸苄酯又名苯丙烯酸苄酯,常作为定香剂,可用于香皂及食品香精的调香原料。以下是一种合成肉桂酸苄酯的路线。
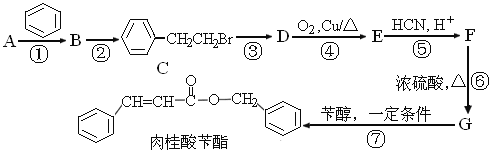
已知:I.相同条件下,烃A对氢气的相对密度为13
Ⅱ.反应①、反应②的原子利用率均为100%
III.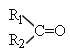
![]()
回答下列问题:
(1)A的结构简式为________,G中的官能团的名称是____________。
(2)反应③的条件为_______。上述合成路线①~⑦步涉及的反应中,属于取代反应的有__________(填编号)。
(3)写出反应D→E的化学方程式___________________________。
(4)F同时满足下列条件的同分异构体共有_________种(不考虑立体异构)。
①苯环上有2个取代基
②能发生银镜反应和水解反应
③能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示6组峰,且峰面积比为3 :2: 2:1:1:1的是___________(填结构简式)。
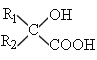
(5)参照上述合成路线,以CH3CHO为原料,设计制备![]() 的合成线路(无机试剂及溶剂任选)_____________________________。
的合成线路(无机试剂及溶剂任选)_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下,则下列说法不正确的是
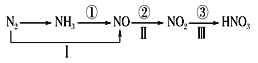
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气在足量的氧气中通过一步反应可生成NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com