
【题目】某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO ![]() 的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.1:3
B.4:3
C.2:1
D.3:1
【答案】C
【解析】解:Cl2生成ClO ![]() 与ClO﹣是被氧化的过程,化合价分别由0价升高为+5价和+1价,ClO﹣与ClO
与ClO﹣是被氧化的过程,化合价分别由0价升高为+5价和+1价,ClO﹣与ClO ![]() 的物质的量浓度之比为3:1, 则可设ClO
的物质的量浓度之比为3:1, 则可设ClO ![]() 为1mol,ClO﹣为3mol,被氧化的Cl共为4mol,
为1mol,ClO﹣为3mol,被氧化的Cl共为4mol,
失去电子的总物质的量为1mol×(5﹣0)+3mol×(1﹣0)=8mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成KCl是被还原的过程,化合价由0价降低为﹣1价,
则得到电子的物质的量也应为8mol,
则被还原的Cl的物质的量为8mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为8mol:4mol=2:1,
故选C.
Cl2生成ClO ![]() 与ClO﹣是被氧化的过程,Cl2生成KCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO3﹣与ClO﹣的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被氧化的氯元素和被还原的氯元素的物质的量之比
与ClO﹣是被氧化的过程,Cl2生成KCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO3﹣与ClO﹣的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被氧化的氯元素和被还原的氯元素的物质的量之比


科目:高中化学 来源: 题型:
【题目】科学家在研究金属矿物质组分的过程中,发现了Cu﹣Ni﹣Fe等多种金属互化物.
(1)鉴别某种金属互化物是晶体还是非晶体的方法是 .
(2)已知高温下Cu2O比CuO更稳定,试从铜原子核外电子变化角度解释其原因 .
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2 . (SCN)2分子中硫原子的杂化方式是 , σ键和π键数目之比为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,其原因是 .
(4)立方FeO晶体的结构如图1所示,设晶胞边长为a cm,密度为b gcm﹣3 , 则阿伏加德罗常数可表示为(用含a、b的式子表示).人工制备的FeO晶体常存在缺陷(如图2),已知某氧化物样品组成为Fe0.96O,该晶体中Fe3+与Fe2+的离子个数之比为 . 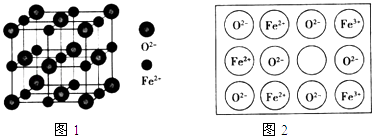
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.酶的催化条件通常比较温和
B.酶在重金属盐作用下会失去活性
C.DNA是生物体遗传信息的载体、蛋白质合成的模板
D.RNA主要存在于细胞核中,它根据DNA提供的信息控制体内蛋白质的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四种化合物:①NaHCO3;②Al(OH)3;③Al2O3;④H2N—CH2—COOH中跟盐酸和氢氧化钠溶液都能反应的是( )
A.②④
B.①②
C.①②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气.
氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如图1:
回答下列问题:
(1)仪器A的名称为 , 甲中活性炭的作用是 , B中加入的药品是 . 实验时从仪器C中放出溶液的操作方法是 .
(2)装置丁中发生反应的离子方程式为 . 用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,图2中可选用的发生装置是(填写字母).
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为 , 分离产物的方法是 .
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为 . 为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
B.用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小
C.用湿润的pH试纸测稀碱液的pH,测定值偏小
D.测定中和反应反的应热时,将碱液缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知如下氧化还原反应2BrO ![]() +Cl2=Br2+2ClO
+Cl2=Br2+2ClO ![]() 5Cl2+I2+6H2O=2HIO3+10HCl ClO
5Cl2+I2+6H2O=2HIO3+10HCl ClO ![]() +5Cl﹣+6H+=3Cl2+3H2O 则下列各微粒氧化能力强弱顺序正确的是( )
+5Cl﹣+6H+=3Cl2+3H2O 则下列各微粒氧化能力强弱顺序正确的是( )
A.ClO ![]() >BrO
>BrO ![]() >IO
>IO ![]() >Cl2
>Cl2
B.BrO ![]() >Cl2>ClO
>Cl2>ClO ![]() >IO
>IO ![]()
C.BrO ![]() >ClO
>ClO ![]() >Cl2>IO
>Cl2>IO ![]()
D.Cl2>BrO ![]() >ClO
>ClO ![]() >IO
>IO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去氯化镁酸性溶液中的Fe3+,可以在加热搅拌的条件下加入一种过量的试剂,过滤后再加入适量的盐酸。这种试剂是( )
A. 氨水 B. 氢氧化钠 C. 碳酸钠 D. 碳酸镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
①NaHCO3溶液加水稀释, ![]() 的比值保持增大
的比值保持增大
②浓度均为0.1molL﹣1的Na2CO3、NaHCO3混合溶液:2c(Na+)═3[c(CO ![]() )+c(HCO
)+c(HCO ![]() )]
)]
③在0.1molL﹣1氨水中滴加0.1molL﹣1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH﹣)=10﹣amolL﹣1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO ![]() )均增大
)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH﹣)+c(H2S)+c(HS)
A.①④
B.②⑤
C.①③
D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com