
【题目】科学家在研究金属矿物质组分的过程中,发现了Cu﹣Ni﹣Fe等多种金属互化物.
(1)鉴别某种金属互化物是晶体还是非晶体的方法是 .
(2)已知高温下Cu2O比CuO更稳定,试从铜原子核外电子变化角度解释其原因 .
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2 . (SCN)2分子中硫原子的杂化方式是 , σ键和π键数目之比为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,其原因是 .
(4)立方FeO晶体的结构如图1所示,设晶胞边长为a cm,密度为b gcm﹣3 , 则阿伏加德罗常数可表示为(用含a、b的式子表示).人工制备的FeO晶体常存在缺陷(如图2),已知某氧化物样品组成为Fe0.96O,该晶体中Fe3+与Fe2+的离子个数之比为 . 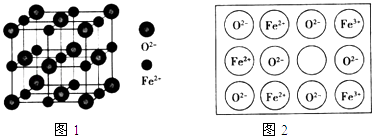
【答案】
(1)X射线衍射
(2)Cu+的最外层电子排布式为3d10 , 而Cu2+的最外层电子排布为3d9 , 因为最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO
(3)sp3;5:4;异硫氰酸分子间能形成氢键而硫氰酸不能形成氢键
(4)![]() ?/mol;1:11
?/mol;1:11
【解析】解:(1)晶体、非晶体的方法是X射线衍射,所以答案是:x射线衍射;(2)轨道中电子处于全满、全空、半满时原子最稳定,Cu+的最外层电子排布式为3d10 , 而Cu2+的最外层电子排布为3d9 , 因为最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO,所以答案是:Cu+的最外层电子排布式为3d10 , 而Cu2+的最外层电子排布为3d9 , 因为最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO;(3)(SCN)2分子中分子结构式为N≡C﹣S﹣S﹣C≡N,每个S原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论知硫原子的杂化方式为sp3 , 该分子中σ键和π键数目之比为5:4;含有氢键的物质熔沸点较高,异硫氰酸分子间能形成氢键而硫氰酸不能形成氢键,所以硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,所以答案是:sp3;5:4;异硫氰酸分子间能形成氢键而硫氰酸不能形成氢键;(4)该晶胞中亚铁离子个数=8× ![]() +6×
+6× ![]() =4,氧离子个数=1+12×
=4,氧离子个数=1+12× ![]() =4,
=4,
设晶胞边长为a cm,晶胞体积为a3cm3 , 密度为b gcm﹣3 , 阿伏加德罗常数= ![]() =
= ![]() /mol=
/mol= ![]() /mol;
/mol;
某氧化物样品组成为Fe0.96O,化合物中各元素化合价的代数和为0,根据电荷守恒判断该晶体中Fe3+与Fe2+的离子个数之比,设Fe3+与Fe2+的个数分别是x、y, ![]() ,得
,得![]() ,所以x:y=0.08:0.88=1:11,
,所以x:y=0.08:0.88=1:11,
所以答案是: ![]() /mol;1:11.
/mol;1:11.
【考点精析】关于本题考查的氢键的存在对物质性质的影响,需要了解氢键主要存在于HF、H2O、NH3、CH3CH2OH分子间;故HF、H2O、NH3的沸点分别与同族氢化物沸点相比反常的高才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】【化学选修2:化学与技术】
(1)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸.某企业用右图所示的工艺流程生产硫酸:请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装(填设备名称).吸收塔中填充有许多瓷管,其作用是 .
②为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%.为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 . 假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 . (空气中氧气的体积分数按0.2计),该尾气的处理方法是 .
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是(可多选).
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面(可多选).
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要的食物,又是重要的化工原料。油脂的以下性质和用途中与其含有不饱和键有关的是( )
A.适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素
B.利用油脂在碱性条件下的水解,可以生产甘油和肥皂
C.植物油通过氢化可以制造植物奶油(人造奶油)
D.脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( ) 
A.反应在50s~250s内的平均速率v(PCl3)=4.0×10﹣4molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl5)=0.38 molL﹣1 , 则反应的△H<0
C.保持其他条件不变,将容器的容积缩小一半,平衡逆向移动,化学平衡常数减小
D.相同温度下,起始时向容器中充入0.5 mol PCl5 , 重新达到平衡时,0.1 mol<n(PCl3)<0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常常碰到涉及化学知识的某些问题,下列叙述正确的是( )
①人的皮肤在强紫外线的照射下将会失去生理活性 ②用甲醛溶液浸泡海产品保鲜 ③变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 ④棉花和木材的主要成分都是纤维素,禽类羽毛和蜘蛛丝的主要成分都是蛋白质 ⑤蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水
A.①④⑤
B.②③④
C.①②④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 . 已知该反应中H2O2只发生如下过程:H2O2﹣→O2 .
(1)该反应中的还原剂是 .
(2)该反应中,发生还原反应的过程是→ .
(3)写出该反应的化学方程式,并用单线桥法标出电子转移的方向和数目 .
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是元素周期表的一部分,根据给定的元素回答下列问题
(1)K的元素符号是;
(2)D元素的外围电子排布图是 , 在其化合物中,最高正价是;
(3)C元素的原子结构示意图是;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是分子(填极性或非极性),B与L(1:1)的化合物的电子式是;
(5)G、H、L原子的第一电离能由高到低的顺序是(填元素符号);
(6)J单质的一种白色同分异构体的空间构型是;
(7)E元素在元素周期表中的位置是 , 在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机高分子合成材料K的合成路线如图(部分反应条件和产物略去)所示.
已知:Ⅰ.RCHO+R′CH2CHO ![]()
![]() +H2O(R,R′表示烃基或氢)
+H2O(R,R′表示烃基或氢)
Ⅱ.RCHO+ ![]()
![]()
 +H2O
+H2O
(1)A是相对分子质量为92的芳香烃,则A的分子式为 , G→H的反应类型为 .
(2)检验E中含氧官能团的试剂为(填名称).
(3)符合下列条件的有机物F的同分异构体有种(不考虑顺反异构);其中核磁共振氢谱中有5组峰,且峰面积之比为3:2:2:2:1的是(写结构简式).①遇FeCl3溶液显紫色;
②能与溴水发生加成反应;
③属于芳香化合物.
(4)写出F和J反应生成K的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO ![]() 的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.1:3
B.4:3
C.2:1
D.3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com