
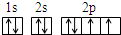
 ,故答案为:
,故答案为: ;
;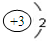 ,
,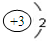 ;
;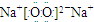 ,由于在SiO2中,每个硅原子周围有4个Si-O键,所以1molSiO2中含有共价键为4mol,在元素周期表中,同周期元素从左向右,电负性逐渐增大,同周期元素从上向下,电负性逐渐减小,所以Na、Si、O、P四种元素的电负性由大到小的顺序是O>P>Si>Na,
,由于在SiO2中,每个硅原子周围有4个Si-O键,所以1molSiO2中含有共价键为4mol,在元素周期表中,同周期元素从左向右,电负性逐渐增大,同周期元素从上向下,电负性逐渐减小,所以Na、Si、O、P四种元素的电负性由大到小的顺序是O>P>Si>Na,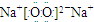 ;4;O>P>Si>Na.
;4;O>P>Si>Na.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | ||
| Z |
| A、X最外层电子数为2,处在ⅡA族 |
| B、Y的单质与氢气化合很容易 |
| C、Y的最高正价为+7,最低负价为-1 |
| D、Z是活泼的金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X中肯定有碳碳双键 |
| B、X中可能有三个羟基和一个 一COOR官能团 |
| C、X中可能有两个羧基和一个羟基 |
| D、X中可能有三个羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛.请回答:
有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13 | B、12 | C、11 | D、10 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①和② | B、①和③ |
| C、③和④ | D、②和④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com