
 ,
, ;
;


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
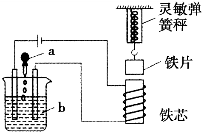 如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )
如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )| A、NaOH、H2SO4 |
| B、BaCl2、NaOH |
| C、Ba(OH)2、Na2SO4 |
| D、NH3?H2O、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,用0.1mol/LHCl滴定10mL0.1mol/LNa2CO3,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol/LHCl滴定10mL0.1mol/LNa2CO3,滴定曲线如图所示.下列说法正确的是( )| A、水电离程度由大到小的顺序为:a>b>c>d |
| B、a点时:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| C、b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| D、d点时:c(H+)>c(HCO3-)=c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
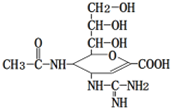 “甲型H7N9”流感疫情已构成“具有国际影响的公共卫生紧急事态”.已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示.下列说法正确的是( )
“甲型H7N9”流感疫情已构成“具有国际影响的公共卫生紧急事态”.已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示.下列说法正确的是( )| A、该物质的分子式为C12H19N4O7 |
| B、1mol该物质与NaOH溶液反应,可以消耗4molNaOH |
| C、在一定条件下,该物质可以发生消去、加成、取代等反应 |
| D、该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E元素+3价离子外围电子排布式为3d5.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E元素+3价离子外围电子排布式为3d5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②③⑤ |
| C、①③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3个 | B、4个 | C、5个 | D、6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com