
【题目】下列各组指定的元素,不能形成AB2型化合物的是( )
A.2s22p2 和2s22p4 B. 3s23p4 和2s22p4 C.3s2和2s22p5 D. 3s1和3s23p5
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分。 X 原子最外层电子数是其内层电子数的3倍。下列说法正确的是

A. TX2、T2 或X3均可用于做杀菌消毒
B. W元素的单质溶于水和汽化都只破坏了分子间作用力
C. 元素T 的非金属性比W强,所以HT的酸性比HW的酸性强
D. YT3在常压、 178℃时升华,所以 YT3 中只含有离子键,而 ZT4中只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l)![]() C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
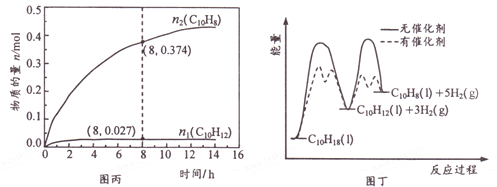
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。

①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是 ( )
A.丙烷与氯气在光照的作用下生成氯丙烷的反应
B.乙烯与水生成乙醇的反应
C.乙烯与溴的四氯化溶液生成溴乙烷的反应
D.乙烯自身生成聚乙烯的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.9克的镁铝合金,投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入4mol/L的氢氧化钠溶液,若要生成沉淀最多,加入这种氢氧化钠溶液的体积是()
A.125mL B.200mL C.250mL D.560mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种红棕色金属氧化物,B、D是常见的金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的化学式:A:_________I:_________J:_________G:_________;
(2)按要求写出下列反应的方程式
C→I的离子方程式:_____________________________________
F→G的化学方程式:_____________________________________
(3)将一定量A和C混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:

①混合物中含A的质量为______________;
②所用硫酸溶液物质的量浓度为___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号___________;B的元素名称___________;
(2)D的原子的电子式____________;C原子的电子排布式___________________。
(3)A、B、C三种元素形成的简单离子的半径由大到小的顺序是_____________。
(4)CA2与D元素的单质在水溶液中反应的化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l)![]() C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。
①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃化合物A(C9H12O)常用于药物及香料的合成,A的苯环上只有一个支链,支链上只有两种不同环境的氢原子,A有如下转化关系:

已知以下信息:
①
②![]()
请回答下列问题:
(1)A生成B的反应类型为________,由D生成E的反应条件为___________。
(2)F的官能团名称为________,_____________。
(3)I的结构简式为______________。
(4)由E生成F的反应方程式为________________。
(5)F有多种同分异构体,写出符合下列条件的同分异构体的结构简式为______________。
①能发生水解反应和银镜反应;
②属于芳香族化合物且分子中只有一个甲基;
③具有5个核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上往明试剂和反应条件)。_________________
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上往明试剂和反应条件)。_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com