
【题目】氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l)![]() C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。
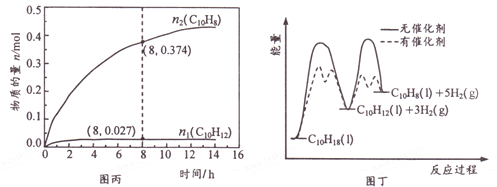
①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
【答案】 为H2S热分解反应提供热量 4H2S+2SO2==4H2O+3S2 BH2NH2或(BH2NH2) NH3BH3-6e-+2H2O=NH4++BO2-+6H+ > 1.951 反应2的活化能比反应1的小,催化剂显著降低了反应2的活化能,反应生成的C10H12很快转变成C10H8,故n1显著低于n2
【解析】(1)使部分硫化氢燃烧,放出热量,为硫化氢热分解反应提供热量,二氧化硫与硫化氢进一步反应,生成物在常温下均非气体,二者反应生成S2与H2O,反应的化学方程式:4H2S+2SO2===4H2O+3S2,答案为:为H2S热分解反应提供热量、4H2S+2SO2===4H2O+3S2
(2)①110 ℃时分析固体残留率随温度的变化图可知,M(A)=M(NH3BH3)×93.55%=31×93.55%=29,故A为BH2NH2或(BH2NH2)n, ②氨硼烷在原电池的负极失电子生成NH4BO2,电极反应式为NH3BH3-6e-+2H2O===NH4++BO2-+6H+,答案为:①BH2NH2或(BH2NH2)n ②NH3BH3-6e-+2H2O===NH4++BO2-+6H+
(3)①由图丁可知ΔH1和ΔH2都是吸热反应,且ΔH1的活化能高于ΔH2的活化能,所以ΔH1>ΔH2②①温度335℃,在8 h时,十氢萘为1.00 mol,测得C10H12和C10H8的产率x1=0.027,x2=0.374,即生成C10H12和C10H8的物质的量分别为0.027mol,0.374mol,设反应的C10H18的物质的量为a,反应C10H12的物质的量为b,根据反应,
C10H18(l)![]() C10H12(l)+3H2(g)
C10H12(l)+3H2(g)
113
aa3a
C10H12(l)![]() C10H8(l)+2H2(g),
C10H8(l)+2H2(g),
112
bb2b
则a-b=0.027,b=0.374,则a=0.401,因此生成的氢气的物质的量分数为3a+2b=3×0.401+2×0.374=1.951,则氢气的量为1.951mol。③反应2的活化能比反应1小,相同温度下反应2更快,所以相同时间内,生成的四氢萘大部分都转化为萘,故n1显著低于n2,故答案为:反应2的活化能比反应1小,相同温度下反应2更快,所以相同时间内,生成的四氢萘大部分都转化为萘,故n1显著低于n2;答案为:①>②1.951③反应2的活化能比反应1的小,催化剂显著降低了反应2的活化能,反应生成的C10H12很快转变成C10H8,故n1显著低于n2


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】在同温同压下,A容器中的氧气(O2)和B容器中的氨气(CH4)所含的原子个数相同,则A、B两容器中气体的体积之比是 ( )
A. 5:2 B. 2:1 C. 2:5 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组指定的元素,不能形成AB2型化合物的是( )
A.2s22p2 和2s22p4 B. 3s23p4 和2s22p4 C.3s2和2s22p5 D. 3s1和3s23p5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用钒炉渣(主要含FeO·V2O5,还有少量SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,该过程中被氧化的元素是_______________;浸出渣的主要成分为____________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为__________。
(3)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210℃时,剩余固体物质的化学式为_____________________。

(4)由V2O5冶炼金属钒采用铝热法,引发铝热反应的实验操作是__________________.
(5)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,俯视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙炔为原料,制取CH2Br-CHBrCl,可行的反应途径是( )
A.先加Cl2,再加Br2B.先加Cl2,再加HBr
C.先加HCl,再加HBrD.先加HCl,再加Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
②H2(g)+![]() O2(g)=H2O(g)△H2
O2(g)=H2O(g)△H2
③C(s)+O2(g)=CO2(g)△H3
④4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)△H4
下列说法不正确的是( )
A. △H4=12△H3+10△H2﹣2△H1
B. 若将①中 H2(g)改为 H2(l)则△H>△H1
C. C(金刚石,s)与 C(石墨,s)的燃烧热不同
D. △H2是 H2(g)的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一张照片,一只可爱的小猫站在一块高分子合成材料上,下面是烈火灼烧,而小猫却若无其事。这说明此高分子材料一定具有的性质是
A. 良好的导热性 B. 良好的绝缘性 C. 良好绝热性 D. 熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选做-选修3:物质结构与性质】硒化锌是一种半导体材料,回答下列问题。
(1)锌在周期表中的位置_______;Se基态原子价电子排布图为______。元素锌、硫和硒第一电离能较大的是________(填元素符号)。
(2)Na2SeO3分子中Se原子的杂化类型为_______;H2SeO4的酸性比H2SeO3强,原因是_______。
(3)气态SeO3分子的立体构型为_______;下列与SeO3互为等电子体的有__(填序号)。
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为______(填元素符号);该晶胞中硒原子所处空隙类型为_____(填“立方体”、“正四面体”或正八面体”);若该品晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏加德罗常数的数值,则晶胞参数a为_______nm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com