
【题目】某同学用如图所示装置进行实验,下列说法错误的是
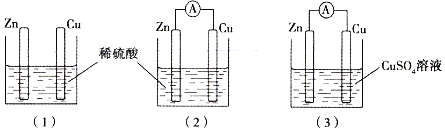
A. 若使图(1)装置中的Zn棒和Cu棒直接接触,则Cu棒上能看到有气体产生
B. 图(2)装置中SO42-向着Zn棒移动
C. 若将图(2)装置中Zn改为Mg,则Cu棒上产生气体的速率加快
D. 当图(2)装置与图(3)装置中正极生成物的质量比为1∶16时,两装置中Zn棒减轻的质量相等
【答案】D
【解析】
A、Zn、Cu直接接触就能构成闭合回路而形成原电池,稀硫酸作电解质溶液,所以Cu捧上可看到有气体产生,故A正确;
B、该原电池中锌比铜活泼,锌为负极,铜为正极,在原电池中,阴离子向负极移动,SO42-带负电荷,因此SO42-向着Zn棒移动,故B正确;
C、由于Mg失电子能力强于Zn,所以将Zn改为Mg时,电子转移速率加快,生成H2的速率也加快,故C正确;
D、图(2)装置中正极上生成氢气,图(3)装置中正极上生成铜,若图(2)装置中正极上产生2gH2,则转移2mol电子,消耗负极Zn65g,则图(3)装置中正极上析出32gCu时转移1mol电子,消耗负极Zn32.5g,即两装置中Zn棒减轻的质量不相等,故D错误;
答案选D。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的纯净、干燥的气体 (考虑尾气吸收)。关于这些装置的连接方法正确的是 ( )

A. 实验室用石灰石与稀盐酸制备收集CO2:b→f→d→e
B. 实验室用锌粒与稀硫酸制备收集H2:b→c→g
C. 实验室利用H2O2与二氧化锰制备收集O2:a→c→e
D. 实验室用浓氨水与生石灰反应制备收集NH3:b→d→e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室可用KMnO4和浓盐酸反应制取氯气。
2KMnO4+16HCl(浓) ![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出电子转移的方向和数目。____________________
(2)将上述配平的化学方程式改写为离子方程式__________________________________ 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl________mol,转移的电子的数目约为____________。
II.根据反应Cu+4HNO3(浓)![]() Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原产物是______。
②氧化剂与氧化产物的物质的量之比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
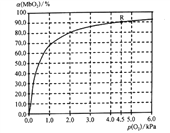
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是 ( )
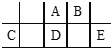
A. A有5种正价,与B可形成6种化合物
B. 工业上常通过电解熔融态C2B3的方法来获得C的单质
C. 简单离子的半径由大到小为:E>A>B>C
D. D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关镁及其化合物的离子方程式书写正确的是( )
A.MgCO3与盐酸反应:CO32-+2H+=CO2↑+H2O
B.Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42-=MgSO4↓+2H2O
C.镁与醋酸反应:Mg+2H+=Mg2++H2↑
D.氯化镁溶液与AgNO3溶液反应:Ag++Cl-=AgCl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL FeI2溶液中逐渐通入Cl2,其中n(I2)、n(Fe3+)随通入n(Cl2)的变化如图所示,下列说法不正确的是
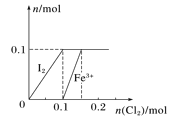
A. 还原性强弱:Fe2+<I-
B. n(Cl2)=0.12 mol时,溶液中的离子主要有Fe2+、Fe3+、Cl-
C. 由图可知,该FeI2溶液的浓度为1mol·L-l
D. n(Cl2)∶n(FeI2)=1∶2时,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com