
【题目】热化学方程式C(s)+H2O(g) ![]() CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气完全反应生成一氧化碳气体和氢气,并吸热131.3kJ热量
D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为__;氧原子个数之比为___。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92g该氧化物的体积为448mL,则该氧化物的摩尔质量为___,R的相对原子质量为__。
(3)常温下,在27.5g水中溶解12.5gCuSO4·5H2O,恰好达到饱和,该溶液的密度为1.21g/cm3,则该溶液中CuSO4的物质的量浓度约为__,从中取出20.0mL该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改良Claus法利用天然气脱硫产生的H2S回收单质硫,首先将原料气通入反应炉并发生高温反应Ⅰ:2H2S(g) + 3O2(g) =2SO2(g) + 2H2O(g);反应后的混合气体通入串联的多个温度逐渐降低的转化器内进行反应Ⅱ:2H2S(g) + SO2(g)![]() 3S(l) + 2H2O(g)。下列说法正确的是
3S(l) + 2H2O(g)。下列说法正确的是
A.反应Ⅰ、Ⅱ消耗等量H2S时,转移电子数之比为2:1
B.根据工艺流程判断反应Ⅱ为吸热反应
C.通过串联多个转化器可提高硫的回收率
D.反应Ⅰ中消耗H2S的量占通入H2S总量的![]() 时,硫的回收率最高
时,硫的回收率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是( )
A. 由H和Cl形成共价键的过程:![]()
B. Na2O2用于呼吸面具的供氧剂:2Na2O2+2CO2=2Na2CO3+O2
C. 实验室用NH4Cl和Ca(OH)2的混合物制取氨:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
D. 惰性电极电解饱和食盐水的离子方程式:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是
A. 氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
B. 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
C. 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目小于0.6×6.02×1023
D. 已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸溶液与含1 mol NaOH的溶液混合,放出的热量要小于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z。X原子的电子层数与核外电子总数相同,Z原子有两个电子层,最外层电子数是内层电子数的三倍,则:
(1)写出元素符号:X_______, Y _________ ; Z的离子结构示意图为__________。
(2)由Y、Z组成,且质量比为7:20的化合物化学式为____________ 。
(3)X、Z可以形成两种常见化合物A和B,A中X、Z原子个数比为2 : 1,则A的摩尔质量为_____,实验室常用B制少量的氧气,写出化学反应方程式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成氨反应的化学方程式为3H2(g)+N2(g)![]() 2NH3(g),下列说法能表示合成氨反应达到化学平衡状态的是
2NH3(g),下列说法能表示合成氨反应达到化学平衡状态的是
A. v逆(N2)=3v正( H2)
B. 三个H—H 键断裂的同时有六个N—H 键生成
C. NH3的百分含量保持不变
D. c(N2) : c(H2) : c(NH3)=1 : 3 : 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。
请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式__________________________。
(2)实验室常用MnO2 与浓盐酸反应制备Cl2,装置如图1所示:
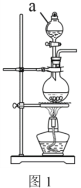
仪器a的名称为______。制备实验开始时,先检査装置气密性,接下来的操作依次是:___________(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图2所示装置:

①装置A中应加入的试剂是____________。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是______,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是_____。
A.AgNO3溶液 B.石蕊试液
C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是___________________。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法______。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述。在基态原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________。
(3)CS2分子中,共价键的类型有_____________,C原子的杂化轨道类型是_______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______________。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
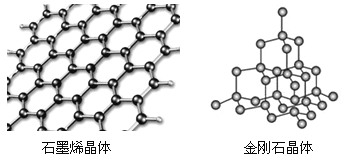
①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com