
【题目】根据题意填空:
(1)估计下列各变化过程是熵增还是熵减.
①NH4NO3爆炸:2NH4NO3(s)═2N2(g)+4H2O(g)+O2(g)
②水煤气转化:CO(g)+H2O(g)═CO2(g)+H2(g)
③臭氧的生成:3O2(g)═2O3(g)
(2)可逆反应A(g)+B(g)2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.
①由T1向T2变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
②由T3向T4变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
③反应在温度下达到平衡
④此反应的正反应为热反应.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】1,2﹣二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用图9所示装置制备1,2﹣二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白:
(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式;该反应类型为 .
(2)写出制备1,2﹣二溴乙烷的化学方程式 .
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象 .
(4)容器c中NaOH溶液的作用是;e装置内NaOH溶液的作用是 .
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K= ![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.升高温度,逆反应速率减小
B.该反应的焓变为正值
C.恒温恒容下,增大压强,H2浓度一定减小
D.该反应的化学方程式为CO+H2O ![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是____________,电解质溶液是_____________。
(2)Y电极发生的电极反应为______________________________。
(3)若开始时X、Y为质量相等的电极,当两极质量差为14克时,转移的电子数为_______。
B.燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内部的新型发电装置,是一种具有应用前景的绿色电源。下图为碱性甲烷燃料电池原理示意图:

总反应:CH4 + 2O2+ 2OH-=CO2-3 + 3H2O
正极:4H2O + 2O2 + 8e- = 8OH-
按照此图的提示回答下列问题:
(1)该燃料电池的负极是______(填“a”或“b”),b电极发生_______反应(填氧化或还原)。
(2)在正极附近溶液的碱性________(填“增强”或“减弱”)。
(3)a电极的电极方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10﹣6 , CaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )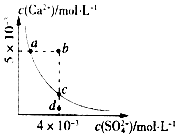
A.在任何溶液中,若有CaSO4沉淀析出,则c(Ca2+)与c(SO42﹣)一定相等
B.d点溶液通过蒸发可以变到c点
C.a点对应的Ksp等于c点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42﹣)一定等于3×10﹣3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4). 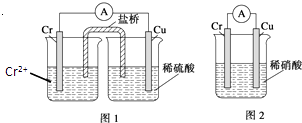
(1)铜铬构成原电池如图1,其中盛稀硫酸烧杯中的现象为: . 盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是: A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl﹣进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
(2)如构成图2电池发现,铜电极上不再有图1的现象,铬电极上产生大量气泡,遇空气呈红棕色.写出正极电极反应式: .
(3)某同学把已去掉氧化膜的铬片直接投入氯化铜溶液时,观察到了预料之外的现象:①铬片表面上的铜没有紧密吸附在铬片的表面而是呈蓬松的海绵状;②反应一段时间后有大量气泡逸出,且在一段时间内气泡越来越快,经点燃能发出爆鸣声,证明是氢气.请解释这两种现象的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW , 该温度下,将浓度为a mol/L的一元酸HA与b mol/L一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.混合溶液的pH=7
B.混合溶液中,c(H+)= ![]() mol/L
mol/L
C.a=b
D.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的快慢和限度对人类生产、生活有重要的意义。
(1)将影响化学反应速率的因素镇在空格处。
实例 | 影响因素 |
食物放在冰箱里延长保质期 | ①___ |
实验室将块状药品研细,再进行反应 | ②___ |
(2)某小组将酸性KMnO4溶液与H2C2O4(具有还原性)溶液混合,用反应中溶液紫色消失快慢的方法研究形响化学反应速率的因素。实验中酸性KMnO4溶液(0.0010mol/L)、H2C2O4溶液的用量均为4mL(忽略加入固体,溶液混合时体积的变化)。
①该反应中氧化剂与还原剂的物质的量之比为________。
②请帮助他们完成以下实验设计表:填写IV中的数据,并将实验目的补充完整。
实验编号 | 温度/K | 催化剂的用量/g | H2C2O4溶液的浓度/mol.L-1 | 实验目的 |
I | 298 | 0.5 | 0.010 | A.实验I和II探究____对反应速率的影响 B.实验I和III探究____对反应速率的影响 C.实验I和IV探究催化剂对反应速率的影响 |
II | 298 | 0.5 | 0.050 | |
III | 323 | 0.5 | 0.010 | |
IV | ____ | ____ | ____ |
③该小组同学对实验II进行了3次实验,测得以下数据:
实验编号 | 溶液退色所需时问t/min | ||
第1次 | 第2次 | 第3次 | |
II | 4.9 | 5.1 | 5.0 |
实验II中用KMnO4表示该反应的平均反应速率为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com