
【题目】常温下,Ksp(CaSO4)=9×10﹣6 , CaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )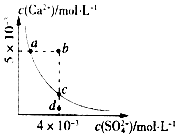
A.在任何溶液中,若有CaSO4沉淀析出,则c(Ca2+)与c(SO42﹣)一定相等
B.d点溶液通过蒸发可以变到c点
C.a点对应的Ksp等于c点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42﹣)一定等于3×10﹣3mol/L
【答案】C
【解析】解:A.CaSO4饱和溶液中c(Ca2+)=c(SO42﹣),若加Na2SO4固体,c(SO42﹣)增大,c(Ca2+)减小,c(SO42﹣)>c(Ca2+),故A错误;
B.d为不饱和溶液,蒸发时硫酸根的浓度会增大,所以d点溶液通过蒸发不能变到c点,故B错误;
C.Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故C正确;
D.根据图示数据,可以看出b点Qc=2×10﹣5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,由于b点c(Ca2+)>c(SO42﹣),生成沉淀时两者减少的离子数目相同,Ksp(CaSO4)=9×10﹣6,则平衡后(Ca2+)>c(SO42﹣),c(SO4﹣)小于3×l0﹣3mol/L,故D错误;
故选C.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有甲、乙两种成分: ![]()
(1)①用酸性高锰酸钾溶液检验甲和乙中含有碳碳双键,方案是否可行(填“可行”或“不可行”). ②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式 .
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物): 
步骤Ⅰ的反应类型为 , Y的结构简式 , 设计步骤Ⅰ的目的是 .
(3)1mol乙最多可与 mol H2发生加成反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业用石英砂做原料通过三个重要反应生产单质硅: SiO2(s)(石英砂)+2C(s)═Si(s)(粗硅)+2CO(g),△H=682.44kJ/mol
Si(s)(粗硅)+2Cl2(s)═SiCl4(g),△H=﹣657.01kJ/mol
SiCl4(g)(纯硅)+2Mg(s)═2MgCl2(s)+Si(s),△H=﹣625.63kJ/mol
生产1.00kg纯硅的总反应热为( )
A.2.43×104kJ
B.﹣2.35×104kJ
C.﹣2.23×104kJ
D.﹣2.14×104kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碱金属单质Li、Na、K性质活泼,均可以保存在煤油中
B.碱金属单质Li、Na、K的熔沸点逐渐升高
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.HF、HCl、HBr、HI的沸点逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法正确的是
A. 煤的干馏可得煤油,乙烯和苯能通过石油分馏得到
B. 油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C. 构成蛋白质的基本单元是氨基酸,构成核酸的基本单元是核甘酸
D. 分子式为C3H8O的有机物,发生消去反应能生成2种烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)估计下列各变化过程是熵增还是熵减.
①NH4NO3爆炸:2NH4NO3(s)═2N2(g)+4H2O(g)+O2(g)
②水煤气转化:CO(g)+H2O(g)═CO2(g)+H2(g)
③臭氧的生成:3O2(g)═2O3(g)
(2)可逆反应A(g)+B(g)2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.
①由T1向T2变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
②由T3向T4变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
③反应在温度下达到平衡
④此反应的正反应为热反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键和共价键的断裂和形成的是
A. 2H2+O2![]() 2H2O B. NH3+HCl=NH4Cl
2H2O B. NH3+HCl=NH4Cl
C. 2Na2O2+2H2O=4NaOH+O2↑ D. 2Mg+CO2![]() 2MgO+C
2MgO+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题. 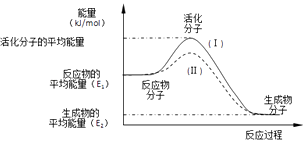
(1)图中所示的反应是(填“吸热”或“放热”)反应,该反应的△H=kJ/mol(用含E1、E2的代数式表示).
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能明显降低,活化分子百分数增多,反应速率加快,你认为最有可能的原因是 .
(3)0.01mol甲苯(分子式为C7H8 , 常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量.该反应的热化学方程式为: .
(4)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C(s)+H2O(g)═CO(g)+H2(g);焓变为△H1 . 已知:①2H2(g)+O2(g)═2H2O(g);△H2=﹣483.6kJ/mol
②2C(s)+O2(g)═2CO(g);△H3=﹣221.0kJ/mol结合上述热化学方程式计算得出△H1=kJ/mol
(5)计算△H1时所用到的基本化学规律叫做定律.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com