
【题目】为除去下列物质中少量的杂质(括号内),请写出所加的试剂或操作,并写出相应的化学方程式:
(1)Na2CO3 固体(NaHCO3):______________,___________________________________。
(2)NaCl溶液中混有少量Na2CO3 :_____________,_______________________________。
(3)铜粉中混有铁粉:______________,_______________________________。
(4)铁粉中混有铝粉:______________,_______________________________。
【答案】加热 2NaHCO3![]() Na2CO3+CO2↑+H2O 盐酸 Na2CO3+2HCl=2NaCl+CO2↑+H2O 硫酸铜溶液 Fe+CuSO4=Cu+FeSO4 NaOH溶液 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Na2CO3+CO2↑+H2O 盐酸 Na2CO3+2HCl=2NaCl+CO2↑+H2O 硫酸铜溶液 Fe+CuSO4=Cu+FeSO4 NaOH溶液 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】
Na2CO3 固体受热不分解,NaHCO3受热可分解,可用加热的方法除杂,反应方程式为: 2NaHCO3 ![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(2)NaCl溶液中混有少量Na2CO3,加入盐酸,Na2CO3与盐酸反应生成氯化钠和水,反应方程式为:Na2CO3 +2HCl=2NaCl+CO2↑+H2O;
(3)铜粉与硫酸铜溶液不反应,铁粉与硫酸铜溶液反应生成铜单质和硫酸亚铁溶液,反应方程式为:Fe+CuSO4=Cu+FeSO4 ;
(4)铁粉与氢氧化钠溶液不反应,铝粉可与氢氧化钠溶液反应,反应方程式为2Al+2NaOH+2H2O=2NaAlO2 +3H2 ↑;
(1)Na2CO3 固体受热不分解,NaHCO3受热可分解,可用加热的方法除杂,反应方程式为: 2NaHCO3 ![]() Na2CO3+CO2↑+H2O,
Na2CO3+CO2↑+H2O,
故答案为:加热;2NaHCO3 ![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(2)NaCl溶液中混有少量Na2CO3,加入盐酸,Na2CO3与盐酸反应生成氯化钠和水,反应方程式为:Na2CO3 +2HCl=2NaCl+CO2↑+H2O,
故答案为:盐酸;Na2CO3 +2HCl=2NaCl+CO2↑+H2O;
(3)铜粉与硫酸铜溶液不反应,铁粉与硫酸铜溶液反应生成铜单质和硫酸亚铁溶液,反应方程式为:Fe+CuSO4=Cu+FeSO4 ,
故答案为:硫酸铜溶液;Fe+CuSO4=Cu+FeSO4 ;
(4)铁粉与氢氧化钠溶液不反应,铝粉可与氢氧化钠溶液反应,反应方程式为2Al+2NaOH+2H2O=2NaAlO2 +3H2 ↑,
故答案为:NaOH 溶液;2Al+2NaOH+2H2O=2NaAlO2 +3H2 ↑;


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )

A.平衡常数:K(a)>K(c) K(b)=K(d)
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)<M(c) M(b)>M(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) = C(g) ΔH,分两步进行:①A(g)+B(g) = X(g)ΔH1 (慢)②X(g) = C(g) ΔH2(快)反应过程中能量变化如下图所示,下列说法正确的是

A.ΔH1+ ΔH2=ΔH >0B.E2表示反应C(g) =X (g)的活化能
C.E1是反应①的反应热D.整个反应的速率快慢由反应②决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,四种水溶液① HCl ,② FeCl3 ,③ KOH ,④ Na2CO3 四种水溶液的PH依次为 4、4 、10 、10 ,各溶液中水的电离程度大小关系正确的是 ( )
A.①=②=③=④B.①>③>②>④C.④=②>③=①D.①=③>②=④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,![]() 是继
是继![]() 、
、![]() 之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是__________(填标号)。
A. 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B. 氢硫酸的导电能力低于相同浓度的亚硫酸
C. ![]() 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的![]() 分别为
分别为![]() 和
和![]()
D. 氢硫酸的还原性强于亚硫酸
(2)![]() 与
与![]() 在高温下发生反应:H2S(g)+CO2(g)
在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.1mol
COS(g)+H2O(g)。在610K时,将0.1mol![]() 与
与![]()
![]() 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①![]() 的平衡转化率
的平衡转化率![]() ________%,反应平衡常数
________%,反应平衡常数![]() ___________________。
___________________。
②在620K重复实验,平衡后水的物质的量分数为0.03,![]() 的转化率
的转化率![]() ______
______![]() ,该反应的
,该反应的![]() ______0。(填“
______0。(填“![]() ”“
”“![]() ”或“
”或“![]() ”)
”)
③向反应器中再分别充入下列气体,能使![]() 转化率增大的是______(填标号)。
转化率增大的是______(填标号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年9月26日,第五届硒博会在恩施州文化中心大剧院开幕。第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2 (g)+O2(g![]() 2H2O(l) △H=b kJ·mol—1
2H2O(l) △H=b kJ·mol—1
反应H2(g)+ Se(s) ![]() H2Se(g)的反应热△H=______kJ·mol-1(用含a、b的代数式表示)。
H2Se(g)的反应热△H=______kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2 (g)+Se(s)![]() H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是_______(填字母代号)。
a. 气体的密度不变 b. v(H2) =v(H2Se)
c. 气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:________________________________________________。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:

则制备H2Se的最佳温度和压强为________。
(3)已知常温下H2Se的电离平衡常数![]() ,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。
,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________,最后通入SO2析出硒单质。
(5) H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9![]() ,CuS的
,CuS的![]() ,则反应CuS(s)+Se2-(aq)
,则反应CuS(s)+Se2-(aq)![]() CuSe(s)+S2-(aq)的化学平衡常数K=_____ (保留2位有效数字)。
CuSe(s)+S2-(aq)的化学平衡常数K=_____ (保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )
A. NaCl→Na++Cl-
NaCl→Na++Cl-
B. CuCl→Cu2++2Cl-
CuCl→Cu2++2Cl-
C. CH3COOHCH3COO-+H+
CH3COOHCH3COO-+H+
D. H2(g)+Cl2(g)→2HCl(g)+183kJ
H2(g)+Cl2(g)→2HCl(g)+183kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:
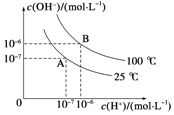
(1)A点水的离子积为1×1014mol2/L2,B点水的离子积为_______.造成水的离子积变化的原因是________。
(2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?_______ ; ______.
(3)100℃时,若盐酸中c(H+)=5×104mol/L,则由水电离产生的c(H+)是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com