
甲同学欲配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制该溶液,需要浓硫酸的体积为________mL;所选用容量瓶的规格为________mL。
(2)甲同学的配制步骤:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①洗涤操作中,将洗涤烧杯后的溶液也注入容量瓶,其目的是________。
②定容的正确操作是继续加蒸馏水至离刻度线下________时,改用________加水至液面与刻度线相切。
③用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填字母序号,下同)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓硫酸
D.重新配制
(3)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出
B.定容时俯视读取刻度
C.容量瓶用蒸馏水洗净后未干燥
D.定容时液面超过了刻度线
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 离子反应、氧化还原反应练习卷(解析版) 题型:填空题
某溶液可能含有Na+、K+、Mg2+、Cu2+等阳离子及MnO4—、SiO32—、AlO2—、CO32—、HCO3—、SO42—、Cl-等阴离子,已知:①该溶液呈无色;②经测定溶液的pH=12;③取少量溶液,加入100 mL 2 mol·L-1稀盐酸进行酸化,有白色沉淀生成,还得到一种无色无味的气体,该气体使澄清石灰水(足量)变浑浊。对酸化后的溶液过滤,得到滤液甲。
(1)由①②③可判断:原溶液中一定不存在的离子是________,一定存在的离子是________。
(2)将滤液甲分成两等份,一份中逐滴加入氨水、最终有白色胶状沉淀,说明原溶液中一定有________(填离子符号),刚开始加入氨水时,没有沉淀产生,原因是____________________________________(用离子方程式表示);另一份中加入足量的Ba(NO3)2溶液,有白色沉淀生成,说明原溶液中一定有________(填离子符号),过滤得到滤液乙。
(3)往滤液乙中加入足量的AgNO3溶液,过滤、洗涤、干燥得固体26.5 g,则原溶液中是否有Cl-?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质结构与性质练习卷(解析版) 题型:填空题
A、B、C、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素。
已知:
A原子的核外电子数与电子层数相等;
B元素原子的核外p电子数比s电子数少1个;
C原子的第一至第四电离能为I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol;
D原子核外所有p轨道为全充满或半充满;
E元素的族序数与周期序数的差为4;
(1)写出E元素在周期表位置:________;D元素的原子的核外电子排布式:____________________。
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为
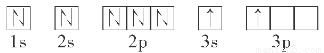
该同学所画的轨道式违背了________。

(3)已知BA5为离子化合物,写出其电子式:______________。
(4)DE3中心原子杂化方式为__________________,其空间构型为______________。
(5)某金属晶体中原子堆积方式如图甲,晶胞特征如图乙,原子相对位置关系如图丙,则晶胞中该原子配位数为________;空间利用率为________;该晶体的密度为________。(已知该金属相对原子质量为m,原子半径为a cm)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质结构、元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是________,C2B2的电子式为________。
(2)B、C、D、F的离子半径由大到小的顺序是________(用离子符号表示)。
(3)E和F相比,非金属性强的是________(用元素符号表示),下列事实能证明这一结论的是________(用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为________(填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为__________________________。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为________,pH=10的乙溶液中由水电离产生的c(OH-)=________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质结构、元素周期律练习卷(解析版) 题型:选择题
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是( )

A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:Y>X
D.X、Z形成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质的量及其应用练习卷(解析版) 题型:选择题
由C16O和C18O组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是( )
A.混合气体中C16O与C18O的分子数之比为14?:15
B.混合气体中C16O与C18O的物质的量之比为1?:1
C.混合气体中C16O与C18O的质量之比为15?:14
D.混合气体中C16O与C18O的密度之比为1?:1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质的组成性质分类及化学用语练习卷(解析版) 题型:选择题
下列有关物质性质的描述和该性质的应用均正确的是( )
A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 有机化学基础练习卷(解析版) 题型:选择题
某有机物结构简式为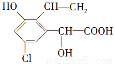 ,下列关于该有机物的说法中不正确的是( )
,下列关于该有机物的说法中不正确的是( )
A.遇FeCl3溶液显紫色
B.与足量的氢氧化钠溶液在一定条件下反应,最多消耗NaOH 3 mol
C.能发生缩聚反应和加聚反应
D.1 mol该有机物与溴发生加成反应,最多消耗1 mol Br2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学能与热能练习卷(解析版) 题型:选择题
下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,一定不能自发进行反应
B.已知:CH4(g)+ O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热
O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热
C.恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)??2C(g),充分反应后测得放出的热量为Q kJ,则该反应的ΔH=-Q kJ/mol
D.由4P(s,红磷)=P4(s,白磷) ΔH=+139.2 kJ/mol,可知红磷比白磷稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com