
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:![]() △H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
△H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
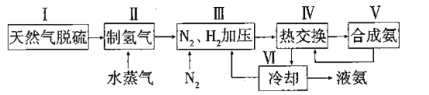
(1)步骤II中制氯气原理如下:
I.![]() △H=+206.4kJ·L-1
△H=+206.4kJ·L-1
II.![]() △H=-41.2kJ·L-1
△H=-41.2kJ·L-1
①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是____________________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应II,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为_______________。
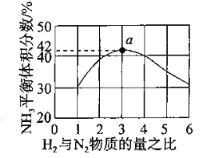
(2)图1表示500℃、60.0Mpa条件下,原料气投料比平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________。
(3)上述流程图中,使合成氨气放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:_______________。
【答案】a 90% 14.5% Ⅳ 对原料气加压,分离液氨,未反应的氮气和氢气循环使用
【解析】
天然气脱硫后得到纯净的甲烷,甲烷与水蒸气反应生成H2和CO,为了得到更多的H2,CO又与水蒸气反应,生成的H2再加入N2后经过加压,利用合成氨放出的热量进行预热处理,再在合成塔里反应,反应后经过热交换后分离出液氨,剩余的混合气体N2和H2循环使用。
⑴①a. 升高温度,速率加快,平衡向吸热反应即正向移动,氢气百分含量增大;b. 增大水蒸气浓度,反应速率加快,平衡正向移动,虽然氢气量增加,但平衡移动是微弱的,总的体积增加的多,氢气百分含量减少;c. 加入催化剂,速率加快,平衡不移动,氢气百分含量不变;d. 降低压强,速率减慢;②建立三段式并根据题意解答。
⑵假设氮气物质的量为1mol,氢气物质的量为3mol,建立三段式并根据题意列出关系式,最后计算N2的平衡体积分数。
⑴①a. 升高温度,速率加快,平衡向吸热反应即正向移动,氢气百分含量增大,故a符合题意;b. 增大水蒸气浓度,反应速率加快,平衡正向移动,虽然氢气量增加,但平衡移动是微弱的,总的体积增加的多,氢气百分含量减少,故b不符合题意;c. 加入催化剂,速率加快,平衡不移动,氢气百分含量不变,故c不符合题意;d. 降低压强,速率减慢,故d不符合题意;综上所述,答案为a。
②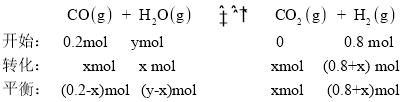
0.2x+x+0.8+x =1.18,则x =0.18,则CO转化率为![]() ;故答案为:90%。
;故答案为:90%。
⑵假设氮气物质的量为1mol,氢气物质的量为3mol,建立三段式 ,
,![]() ,解得x=0.591,N2的平衡体积分数为
,解得x=0.591,N2的平衡体积分数为![]() ;故答案为:14.5%。
;故答案为:14.5%。
⑶上述流程图中,使合成氨气放出的能量得到充分利用是将放出的热量用于原料气预热,主要步骤是IV。该反应是体积减小的反应,因此加压可提高合成氨原料总转化率,分离液氨,未反应的氮气和氢气循环使用提高原料利用率,因此本流程中提高合成氨原料总转化率的方法主要是对原料气加压,分离液氨,未反应的氮气和氢气循环使用;故答案为:IV;对原料气加压,分离液氨,未反应的氮气和氢气循环使用。


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】大豆中含有丰富的蛋白质、脂肪等营养物质,由大豆加工出来的食品很多,深受人们喜爱。请回答下列问题:
(1)我们所吃的豆腐的主要成分是________(填写字母)。
A.凝胶 B.蛋白质 C.脂肪 D.淀粉
(2)点豆腐所采用的凝聚剂是________(填写字母)。
A.石膏 B.硫酸钡 C.氢氧化钠 D.硫酸
(3)我们食用的大豆,最终补充给人体的主要成分是________(填写字母)。
A.氨基酸 B.蛋白质 C.多肽 D.糖类
(4)大豆中含有一定量的酯类。该液态酯类的水解产物是丙三醇(俗称________)和________,其分子结构中________(填“有”或“无”)碳碳双键,丙三醇的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示。p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)。已知硫酸钡在水中溶解吸收热量。下列说法正确的是( )
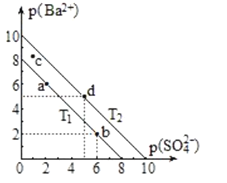
A.温度高低:T1<T2
B.加入BaCl2固体,可使溶液由a点变到b点
C.c点对应的溶液在T1温度时有固体析出
D.T2温度下,BaSO4的Ksp=1×10-25mol2·L-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。
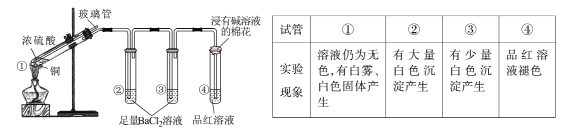
下列说法正确的是
A.②中白色沉淀是BaSO3
B.①中可能有部分硫酸挥发了
C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺![]() 是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和NH3相似,与盐酸反应生成易溶于水的盐
和NH3相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理: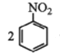 +3Sn+12HCl
+3Sn+12HCl![]()
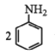 +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
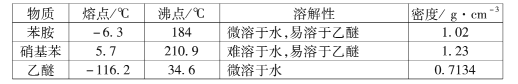
I.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为____;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是____。
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。

(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为____。
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。

ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是____。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是____。
(6)该实验中苯胺的产率为____。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法正确的是
A.0.1molKHSO4晶体中含有H+数为0.1NA
B.标准状况下,5.6LSO3分子中含有的电子总数为10NA
C.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为3NA
D.33.6gFe与足量的水蒸气加热充分反应,转移电子数为1.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,该材料中Ni为主要活泼元素,通常可以简写为LiAO2。充电时总反应为LiAO2+nC=Li1-xAO2+LixCn(0<x<1),工作原理如图所示,下列说法正确的是
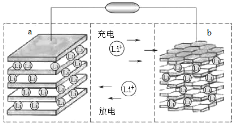
A.放电时Ni元素最先失去电子
B.放电时电子从a电极由导线移向b电极
C.充电时的阳极反应式为LiAO2 xe-= Li1-xAO2 + xLi+
D.充电时转移1mol电子,理论上阴极材料质量增加7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
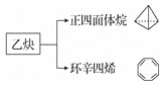
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com