
【题目】根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
Ⅲ、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
Ⅳ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)AsCl3分子的立体构型为_____________,铁原子中有_________个未成对电子。
(4)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的原子是_____。
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(6)某镍白铜合金的立方晶胞结构如图所示。
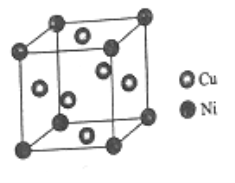
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
【答案】1s22s22p63s23p63d84s2或【Ar】3d84s2O>C>Hsp3和sp27:1三角锥形4配位键NGeCl4、GeBr4、GeI4熔沸点依次升高;原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强3:1![]()
【解析】
(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式;3d能级上的未成对的电子数为2。(2)非金属性越强,电负性越强;乙酸分子中含有甲基碳原子和羧基碳原子,根据价层电子对互斥理论判断碳原子的轨道杂化类型;乙酸分子中单键为σ键,双键中含有1个σ键和1个π键,据此进行解答;(3)锗的卤化物都是分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高;(4)①该晶胞中Ni原子个数=8×1818=1、Cu原子个数=6×1212=3;②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=![]() 。
。
(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;(2)CH3COOH分子中含有C、O、H元素,非金属性:O>C>H,则电负性:O>C>H;CH3COOH分子内含有甲基碳原子和羧基碳原子,甲基碳原子中形成4个σ键,为sp3杂化,羧基碳原子形成3个σ键,无孤对电子,杂化方式为sp2杂化;CH3COOH分子中含有3个C-H键、1个C-C键、1个O-H键、1个C-O单键及1个碳氧双键,单键为σ键,双键中含有1个σ键和1个π键,所以CH3COOH分子中含有7个σ键、1个π键,σ键与π键数目之比为7:1;(3)锗的卤化物都是分子晶体,分子间通过分子间作用力结合,对于组成与结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,由于相对分子质量:GeCl4<GeBr4<GeI4,故沸点:GeCl4<GeBr4<GeI4;(4)①该晶胞中Ni原子个数=8×![]() =1、Cu原子个数=6×
=1、Cu原子个数=6×![]() =3,则Cu、Ni原子个数之比为3:1;②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=
=3,则Cu、Ni原子个数之比为3:1;②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料,以它为原料还可以合成很多的化工产品。现有以下转化:
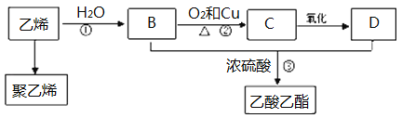
(1)聚乙烯的结构简式为 ;
(2)写出以下反应的化学方程式和反应类型:
② ,反应类型是
③ ,反应类型是
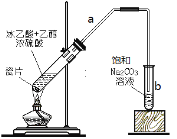
(3)实验室用如图装置制备乙酸乙酯:试管中碎瓷片的作用是 ;导管a的作用是导气和 ;试管b内饱和Na2CO3溶液的作用一方面是除去乙酸乙酯中混有的乙酸和乙醇,另一方面是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列有关容量瓶的使用方法的操作中,错误的是_________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中到刻度线齐平处
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒、摇匀。
(2)实验室中需2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是______________。
A.1000mL; 212g B.950mL;543.4g
C.任意规格; 572g D.500mL; 106g
(3)现用98%、密度为1.8g/mL的浓硫酸配制500mL的稀硫酸。请回答下列问题:
①配制稀硫酸时,需要的玻璃仪器有玻璃棒、烧杯、量筒,还缺少的玻璃仪器有_______(填写仪器名称)。
②经计算,配制500mL0.2mol/L的稀硫酸需要上述浓硫酸的体积为___________。
③稀浓硫酸时,实验操作步骤:____________________。
(4)误差
①用量筒量取浓硫酸时仰视读数,导致最终结果______(填“偏大”“偏小”或“不变”);
②定容时仰视读数,导致最终结果__________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯用途广泛,工业上可通过下列流程合成二甘醇及其衍生物。已知:R-OH + SOCl2 → R-Cl + SO2 ↑+ HCl↑ 请回答:

(1)写出B的官能团的电子式________________________。
(2)写出有关物质的结构简式:A_________________D_________________。
(3)指出反应类型:②_________________。
(4)写出下列化学方程式:反应①______________;反应②___________。
(5)①二甘醇又名(二)乙二醇醚,根据其结构判断下列说法正确的是____(填序号)。
a. 难溶于水 b. 沸点较高 c. 不能燃烧
②E的同分异构体很多,写出其中能够发生银镜反应的两种异构体的结构简式_________________。
(6)请写出由1-氯丙烷合成丙酮的合成路线图并注明反应条件(无机试剂任选)________。合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2CH2-Br
Br-CH2CH2-Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)Al2(SO4)3+3H2 ![]() Al2O3 +3SO2 +3H2O 电子转移_______ 氧化剂是______
Al2O3 +3SO2 +3H2O 电子转移_______ 氧化剂是______
(2)6KMnO4 +5KI +3H2O= 6KOH+6MnO+5KIO3 电子转移_____________ 氧化剂是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法不正确的是
A. 除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH
B. 除去金属离子Cu2+、Hg2+,可向溶液中加入Na2S、H2S等沉淀剂
C. 除去某溶液中的SO42-可向溶液中加入镁盐
D. 除去ZnCl2溶液中的Fe3+可向溶液中加入Zn(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤并转移
⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为____________________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、______________。
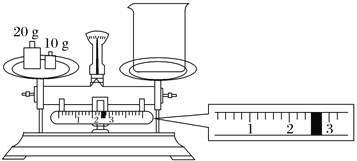
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是____________________________________________。
(4)在配制过程中,其它操作都是正确的(按烧杯的实际质量),下列操作会引起误差偏低的是________。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容后塞上瓶塞反复倒转摇匀,静置后,液面低于刻度线,再加水至刻度线
C.称量时药品和砝码位置放反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(  )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下:
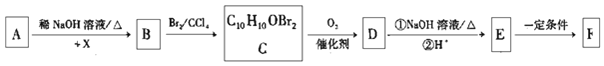
已知:①A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;

请回答下列问题:
(1)X的化学名称是__________。
(2)B生成C的反应类型为__________。
(3)E的结构简式为__________。
(4)由C生成D的化学方程式为__________。
(5)芳香族化合物Y是D的同系物,Y的同分异构体能与饱和Na2CO3溶液反应放出气体,分子中只有1个侧链,核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为6:2:2:1:1。写出两种符合要求的Y的结构简式:__________、__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com