
| A、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| B、用PH试纸测得氯水的PH约为3 |
| C、纯净的H2在Cl2中安静的燃烧,发出苍白色的火焰,集气瓶口有白烟生成 |
| D、氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
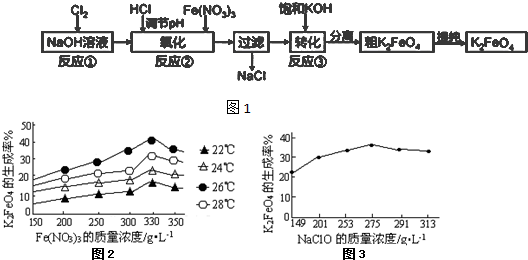
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、②③ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
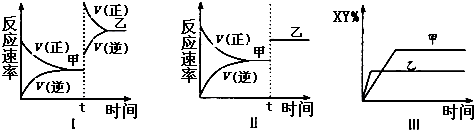
| A、图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2 |
| B、图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低 |
| C、图Ⅱ中,t时间是增大了压强 |
| D、图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B、用锡焊接的铁质器件,焊接处易生锈 |
| C、金属在海水中比在淡水中更易生锈 |
| D、电解熔融的氯化钠制取金属钠,用铁作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体氯化钠不导电,所以氯化钠是非电解质 |
| B、铜丝能导电,所以铜是电解质 |
| C、氯化氢是电解质,其水溶液能导电 |
| D、CO2的水溶液能导电,所以CO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com