
| Fe(OH)3胶体 | CuSO4溶液 | ||
| A | 分散质粒子直径 | 大于100nm(10-7m) | 小于1nm(10-9m) |
| B | 外观 | 介稳体系,均一透明 | 稳定体系,均一透明 |
| C | 能否透过滤纸 | 可以 | 可以 |
| D | 激光笔照射 | 可看到光亮“通路” | 光可透过,但不形成光亮“通路” |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、在含有NaHCO3的溶液中:K+、SO42-、Cl-、Al3+ |
| B、使甲基橙变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、水电离的c(H+)=10-11 mol?L-1的溶液:NH4+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
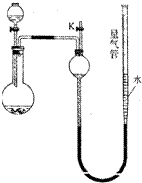 某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究
某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | 铜片、浓HNO3(过量) | NO2 | CCl4 |
| Ⅱ | NH3 | 煤油 | |
| Ⅲ | MnO2,HCl(浓) | Cl2 | |
| Ⅳ | 硅铁合金、NaOH溶液 | H2 | H2O |
| 编号 | 某硅铁合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 336.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
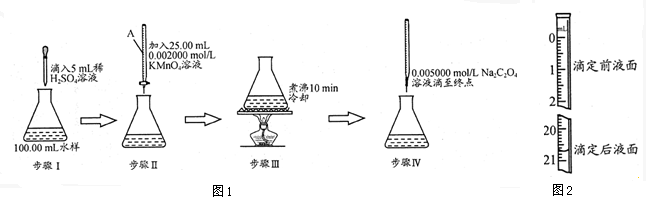
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤一:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤二:在A试管中滴加 | 若 |
| 步骤三:在B试管中滴加 | 若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
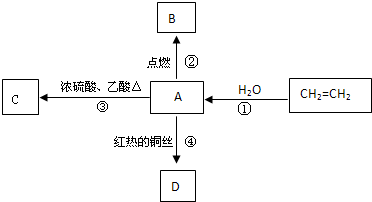
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com