
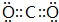 ,CO2与水反应生成碳酸,反应的化学方程式为:CO2+H2O=H2CO3,
,CO2与水反应生成碳酸,反应的化学方程式为:CO2+H2O=H2CO3,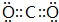 ;CO2+H2O=H2CO3;
;CO2+H2O=H2CO3;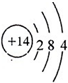 ,
, .
.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、1molH2O含有的H2O分子数目为NA |
| B、1molH2O含有的原子数目为3NA |
| C、32克O2所含的原子数目为NA |
| D、通常状况下,11.2L氮气含氮分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、稀硫酸和氨水反应:H++NH3?H2O═NH4++H2O |
| C、氢氧化钠和硫酸反应:2OH-+H2SO4═SO42-+2H2O |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+═2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe(OH)3胶体 | CuSO4溶液 | ||
| A | 分散质粒子直径 | 大于100nm(10-7m) | 小于1nm(10-9m) |
| B | 外观 | 介稳体系,均一透明 | 稳定体系,均一透明 |
| C | 能否透过滤纸 | 可以 | 可以 |
| D | 激光笔照射 | 可看到光亮“通路” | 光可透过,但不形成光亮“通路” |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
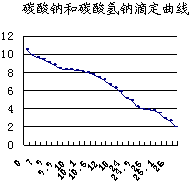 (1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用
(1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用| 实验步骤 | 结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, | 有白色沉淀生成,说明产品中含有NaCl. |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1. | 说明产品中含有NaHCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:
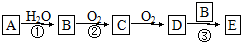
查看答案和解析>>
科目:高中化学 来源: 题型:
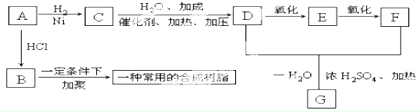
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com