
| 0.85cV |
| 10.00mL×ρg/mL |
| 8.5cV |
| ρ |
| 8.5cV |
| ρ |


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
| A、在含有NaHCO3的溶液中:K+、SO42-、Cl-、Al3+ |
| B、使甲基橙变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、水电离的c(H+)=10-11 mol?L-1的溶液:NH4+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
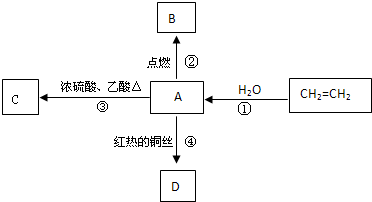
查看答案和解析>>
科目:高中化学 来源: 题型:
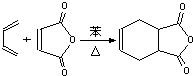 双烯合成也称狄尔斯-阿德耳(Diels-Alder)反应,他们因此获得1950年的诺贝尔化学奖.如图:
双烯合成也称狄尔斯-阿德耳(Diels-Alder)反应,他们因此获得1950年的诺贝尔化学奖.如图:| ①KMnO4/OH-②H+ |
| CrO3,吡啶 |
| CH2Cl2 |
| 500℃ |
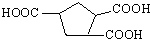 可由烃A和酯B按下列路线合成:
可由烃A和酯B按下列路线合成:
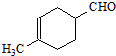 过程.
过程.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地壳中含量最多的金属元素是Al |
| B、金属一般是热和电的良导体 |
| C、自然界中绝大多数金属元素以游离态的形式存在 |
| D、金属一般呈银白色具有金属光泽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN- |
| B、含 有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I- |
| C、c(S2-)=0.1 mol?L-1的溶液中:Na+、NH4+、ClO-、SO42- |
| D、含有大量ClO-的溶液:H+、Mg2+、I-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| B、某溶液中滴加碳酸钠溶液产生白色沉淀,说明原溶液含有Ba2+ |
| C、某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| D、验证烧碱溶液中是否含有Cl-,先加足量的稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com