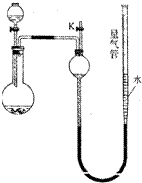
某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | 铜片、浓HNO3(过量) | NO2 | CCl4 |
| Ⅱ | | NH3 | 煤油 |
| Ⅲ | MnO2,HCl(浓) | Cl2 | |
| Ⅳ | 硅铁合金、NaOH溶液 | H2 | H2O |
请回答下列问题:
(1)实验前,某同学检查装置气密性的操作方法是:将活塞K关闭,再将量气管向上提高,其判断装置漏气或不漏气的现象分别是
(2)另一同学欲通过实验1收集并测量NO
2气体的体积来探究铜片的纯度,所测得的结果比真实值偏小(不考虑操作误差),你认为可能的原因是
.
(3)若进行实验Ⅱ制NH
3,则烧瓶和分液漏斗中应分别盛装适量的
.
(4)若进行实验Ⅲ,该装置缺少的必须仪器是
;该反应的离子方程式是
量气管中最好装的液体是
(选填字母代号).
a.NaOH溶液 b水 C.饱和NaCl溶液 d.苯乙烯
(5)实验Ⅳ时,应对量气管多次读数,读数时应注意:
①将实验装置恢复到室温,
②
,
③读数时,视线与凹液面最低处水平相切.
经多次重复实验,获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 某硅铁合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 336.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
根据上述数据,可计算出硅铁合金中硅的质量分数为
.

 某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究
某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究