
| A、铁和盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、足量碳酸氢钠溶液中滴加少量的石灰水:2HCO3-+Ca2++2 OH-═CaCO3↓+CO32-+2H2O |
| C、碳酸钙溶于稀醋酸:CO32-+2H+=H2O+CO2↑ |
| D、氯化钙溶液与CO2的反应:CO2+Ca2++H2O═CaCO3↓+2H+ |


科目:高中化学 来源: 题型:
| 混合物 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 液氧 | 苛性钠 | 胆矾[ | 氧化铁 | 二氧化碳 |
| B | 盐酸 | 烧碱 | 食盐 | 氧化钠 | 一氧化碳 |
| C | 碘酒 | 纯碱 | 石灰石 | 氨气 | 水 |
| D | 大理石 | 熟石灰 | 纯碱 | 生石灰 | 二氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入有色布条,一会儿布条退色,说明溶液中有HClO存在 |
| B、溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在 |
| C、加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D、加入Na2CO3溶液,有气体生成,说明HClO存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含有NaHCO3的溶液中:K+、SO42-、Cl-、Al3+ |
| B、使甲基橙变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、水电离的c(H+)=10-11 mol?L-1的溶液:NH4+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡溶液与盐酸的反应 2OH-+2H+=2H2O |
| B、澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
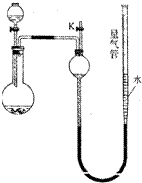 某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究
某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | 铜片、浓HNO3(过量) | NO2 | CCl4 |
| Ⅱ | NH3 | 煤油 | |
| Ⅲ | MnO2,HCl(浓) | Cl2 | |
| Ⅳ | 硅铁合金、NaOH溶液 | H2 | H2O |
| 编号 | 某硅铁合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 336.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤一:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤二:在A试管中滴加 | 若 |
| 步骤三:在B试管中滴加 | 若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地壳中含量最多的金属元素是Al |
| B、金属一般是热和电的良导体 |
| C、自然界中绝大多数金属元素以游离态的形式存在 |
| D、金属一般呈银白色具有金属光泽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com