
【题目】第三周期元素中,微粒半径最大的是
A.NaB.Na+C.S2-D.Cl-
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法正确的是( )
A. 涤纶、有机玻璃、光导纤维都是有机高分子化合物
B. 大豆中含有丰富的蛋白质,豆浆煮沸后蛋白质变为了氨基酸
C. 合成纤维是以木材为原料,经化学加工处理所得
D. 常用于染料、医药、农药等的酚类物质可来源于煤的干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“结构决定性质,性质反映结构”是化学学科重要的学科思想,在有机化学中体现尤为明显。据此回答下列问题:
(1)有机化学中把结构相似、分子组成相差若干个“CH2”原子团的有机化合物互称为同 系物。同系物的化学性质一定_________(填“相同”、“相似”或“不同”),下列有机物中一定属于同系物的是____________(填序号)。
①C3H4和C5H8 ②乙酸和硬脂酸(C17H35COOH)
③![]() 和
和![]() ④淀粉和纤维素 ⑤丙烯和聚乙烯
④淀粉和纤维素 ⑤丙烯和聚乙烯
⑥HOOCCH=CHCOOH和HOOCCH=C(CH3)COOH
(2)在有机物中,当同一官能团连接不同基团时,其表现出来的性质也有所不同。如有机物A(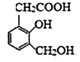 )的分子中有三种烃基(-OH),但由于其直接连接的基团不同而导致活泼性不同。下列转化关系中选用的试剂为①________;②________;③_______。
)的分子中有三种烃基(-OH),但由于其直接连接的基团不同而导致活泼性不同。下列转化关系中选用的试剂为①________;②________;③_______。

醛和酮的分子中都含有羰基(![]() ),但只有醛能被弱氧化剂氧化,请写出葡萄糖与银氨溶液反应的化学方程式:_____________ 。
),但只有醛能被弱氧化剂氧化,请写出葡萄糖与银氨溶液反应的化学方程式:_____________ 。
(3)某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子 不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。
已知:
则产物G的结构简式为__________ ,烃A在一定条件下生成高分子化合物的化学方程式为_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)已知实验室制备氧气可以通过加热高锰酸钾实现,其发生的反应如下:2KMnO4 ![]() K2MnO4+MnO2+O2↑其中被氧化的元素是 , 还原产物是 .
K2MnO4+MnO2+O2↑其中被氧化的元素是 , 还原产物是 .
(2)查阅资料可知:铜和浓H2SO4共热,发生如下反应:Cu+2H2SO4 ![]() CuSO4+SO2↑+2H2O该反应中氧化剂与还原剂的物质的量之比为 , 其中H2SO4在反应中体现性.
CuSO4+SO2↑+2H2O该反应中氧化剂与还原剂的物质的量之比为 , 其中H2SO4在反应中体现性.
(3)在一定条件下,RO3n﹣和氟气可发生如下反应:RO3n﹣+F2+2OH﹣=RO4﹣+2F﹣+H2O从而可知在RO3n﹣中元素R的化合价是 .
(4)请用双线桥表示下列反应方程式中转移的电子数目及方向:
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O
若反应中,发生氧化反应的HCl为1.2mol,则被还原的K2Cr2O7物质的量为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. 2-甲基丁烷也称异丁烷
B. 由乙醇生成乙烯属于消去反应
C. C4H9Cl有3种同分异构体
D. 苯乙烯分子中的所有原子不可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 增大压强
C. 升高温度同时充入N2 D. 及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%浓硫酸配制500mL 2mol/L稀硫酸,下列操作使所配制浓度偏高的是
A. 量取浓硫酸时俯视量筒的刻度线
B. 定容时仰视500mL 容量瓶的刻度线
C. 量取硫酸后洗涤量筒并将洗涤液转入容量瓶
D. 摇匀后滴加蒸馏水至容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定浓度的CuSO4溶液与NaOH溶液反应会生成碱式盐Cux(OH)y(SO4)z。为了测定该碱食盐的
组成,进行了下列实验:
①称取样品2.270g,用足量的稀盐酸溶解配成50.00mL溶液,加入足量的BaCl2溶液,得到 BaSO4 l.l65g。
②另取样品2.270g,溶于足量的稀硫酸配成l00.00mL溶液,取25.00mL溶液加入足量KI溶液 (化学方程式为2Cu2++4I-=2CuI↓+I2)充分反应后,以淀粉为指示剂,用0. 2500mol/LNa2S2O3溶液滴定生成的I2(离子方程式为2S2O32-+I2=2I-+S4O52-),消耗Na2S2O3溶液20.00mL。
(1)写出CuSO4与NaOH反应生成Cux(OH)y(SO4)z的化学方程式______________(用x、y、z表示化学计量数)。
(2)滴定终点时溶液的顔色变化是__________。
(3)通过计算确定该碱食盐的化学式(写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入H2O2的目的是__________。
(2)沉淀A不溶于强酸但可与一种弱酸反应,该反应的化学方程式为______________。
(3)沉淀B的主要成分为_________________________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为
______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com