
【题目】PBAT(聚已二酸对苯二甲酸丁酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物PBA和PBT共聚制得,一种合成路线如下:

已知: 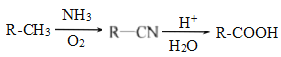
![]()
回答下列问题:
(1)G的官能团的名称为________。
(2)①的反应类型为___________;反应②所需的试剂和条件是___________。
(3)D的结构简式为___________;H的化学名称为___________。
(4)⑤的化学方程式为_______________________________________________。
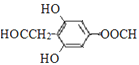
(5)M与G互为同系物,M的相对分子质量比G大14;N是M的同分异构体,写出同时满足以下条件的N的结构简式:___________________(写两种,不考虑立体异构)。
Ⅰ、既能与FeCl3发生显色反应,又能发生水解反应和银镜反应;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1。
(6)设计由丙烯为起始原料制备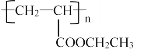 的单体的合成路线(其它试剂可任选)________________________________________________________________。
的单体的合成路线(其它试剂可任选)________________________________________________________________。
【答案】羧基 取代反应 KOH醇溶液,加热 HOOC(CH2)4COOH 1,4-丁二醇 ![]() +2NH3+3O2 →
+2NH3+3O2 →![]() +6H2O
+6H2O 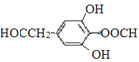 、
、
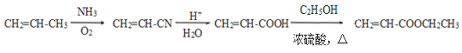
【解析】
由A、C的结构简式,可推知B为![]() ;由信息
;由信息![]() ,可推出D为HOOC(CH2)4COOH;再由PBAT,可推出H的结构简式为HO(CH2)4OH;
,可推出D为HOOC(CH2)4COOH;再由PBAT,可推出H的结构简式为HO(CH2)4OH;
由G结合信息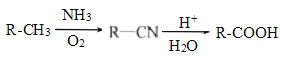 ,可推出E为
,可推出E为![]() ,F为
,F为![]()
(1)G的结构简式为 ,则其所含的官能团的名称为羧基。答案为羧基;
,则其所含的官能团的名称为羧基。答案为羧基;
(2) ① 由![]() →
→ ![]() ,可确定反应类型为取代反应。答案为取代反应;
,可确定反应类型为取代反应。答案为取代反应;
由![]() →
→![]() ,可确定反应类型为消去反应,反应②所需的试剂和条件是KOH醇溶液,加热。答案为KOH醇溶液,加热;
,可确定反应类型为消去反应,反应②所需的试剂和条件是KOH醇溶液,加热。答案为KOH醇溶液,加热;
(3)由上面依据流程图的分析,得出D的结构简式为HOOC(CH2)4COOH。
答案为HOOC(CH2)4COOH;
H的结构简式为HO(CH2)4OH,则H的化学名称为1,4-丁二醇。答案为1,4-丁二醇
(4)⑤的化学方程式为:![]() +2NH3+3O2 →
+2NH3+3O2 →![]() +6H2O。
+6H2O。
答案为![]() +2NH3+3O2 →
+2NH3+3O2 →![]() +6H2O;
+6H2O;
(5)M与G互为同系物,M的相对分子质量比G大14,则M的化学式中比G多一个CH2;N是M的同分异构体,则G除苯环外,还有-CH2COOH、-COOH的异构体部分。
Ⅰ、既能与FeCl3发生显色反应,又能发生水解反应和银镜反应,说明G分子内含有酚羟基、酯基、醛基;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH,说明分子内含有一个酯基,且酯基氧原子连在苯环上,还有2个酚羟基;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1,说明分子内含有5种H原子,且按1:2:2:2:1关系进行分配。
故符合条件的N的结构简式可能为 或
或 ,
,
答案为: 或
或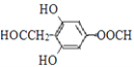 ;
;
(6)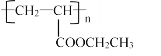 的单体为
的单体为![]() ,由丙烯进行合成,需使用信息
,由丙烯进行合成,需使用信息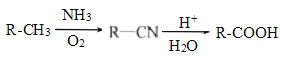 ,故合成路线为:
,故合成路线为:
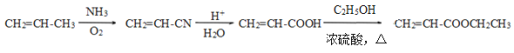
答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】有机物 A 是未成熟葡萄中含有的一种物质,由 C、H、O 三种元素组成,A 在气态时的密度是相同条件下氢气密度的 38 倍。在一定条件下 A 既可以与乙醇反应生成酯又可以与乙酸反应生成酯。已知 0.1mol A 完全燃烧时生成 0.2mol CO2 和 0.2mol H2O;1mol A 可与 2mol Na 或 1mol NaOH 反应。试确定:
(1)有机物 A 的分子式_________________;
(2)写出在浓硫酸作用下,两分子 A 相互反应生成六元环状物质的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制 100 mL 1.00 mol/L NaCl 溶液,下列说法正确的是( )
A.将所需量的 NaCl 溶于 100 mL 水中
B.将所需量的 NaCl 溶于少量水中,再加水定容到 100 mL
C.将所需量的 NaCl 直接放入容量瓶中,加水定容到 100 mL
D.定容时俯视读刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4kJmol-1
2CO(g)+4H2(g) △H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0 kJmol-1
2CO(g)+2H2(g) △H=+247.0 kJmol-1
(1)写出表示CO燃烧热的热化学方程式:_______________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
容器 | 起始物质的量(n) / mol | CO2的 平衡转化率 | |||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是_________。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(H2) = ________(用含t的表达式表示)。
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ_______n(CO)Ⅱ(填“>”、“=”或“<”)
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
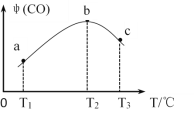
① T2℃时,CO体积分数最大的原因是_____________。
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP =_______(用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
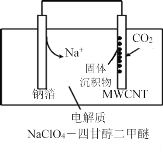
(4)2016年我国科研人员根据反应Na+CO2→ Na2CO3+C(未配平) 研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是课本“还原铁粉与水蒸气反应”的实验装置图。
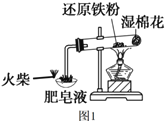
(1)铁粉与水蒸气反应的化学方程式是___。
(2)证明还原铁粉与水蒸气发生了反应的现象是___。
某同学设计图2装置进行“铁与水蒸气反应”的实验。(图中部分夹持及尾气处理装置略)
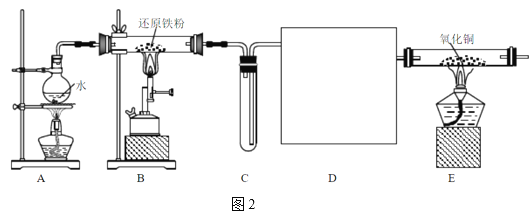
(3)图1装置中湿棉花的作用与图2中___(填“A、B、C、D、E”)装置的作用一样。
(4)装置D的作用是干燥氢气,请在方框内补充完整的装置和试剂___。
(5)实验结束,该同学取反应后装置B中固体混合物溶于足量稀硫酸,再向其中滴加几滴KSCN溶液,振荡,未见溶液变红,得出结论“反应后装置B中固体混合物”不含Fe3O4。你认为正确吗?为什么?你认为___,理由是___。
(6)某同学为实现“常温下铁与液态水的反应”设计了图3装置。实验中发现碳棒上冒气泡,蒸馏水中出现白色沉淀。书写该实验发生的化学方程式___。
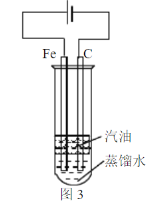
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素,已知Se的原子结构示意图如图:下列说法不正确的是

A. 该原子的质量数为34
B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性
D. 酸性:H2SO4>H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前一个分散系中慢慢地滴入后一种分散系所观察到的现象不是先沉淀后变澄清的是( )
A.氢氧化铁胶体中滴加盐酸
B.四羟基合铝酸钠溶液中加盐酸
C.氯化铝溶液中滴加烧碱溶液
D.氯化铝溶液中滴加氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙烷可作为全身麻醉剂,环已烷是重要的有机溶剂,下面是部分环烷烃及烷烃衍生物的 结构简式、键线式和某些有机化合物的反应式(其中 Pt、Ni 是催化剂)。



回答下列问题:
(1)环烷烃与____________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是____________(填名称)。判断依 据为____________。
(3)环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与 HBr 在一定条件下反 应,其化学方程式为____________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法.试剂____________;现象与结论____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com