
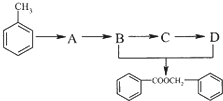
 .
. 的化学方程式为
的化学方程式为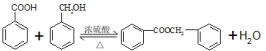 .
.分析 (1)乙烯和溴能发生加成反应而使溴水褪色;
(2)根据各物质的转化关系,由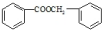 的结构及B生成C,C生成D可知,B为
的结构及B生成C,C生成D可知,B为 ,D为
,D为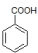 ,所以C为
,所以C为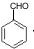 ,A的化学式为C7H7Cl,所以A为
,A的化学式为C7H7Cl,所以A为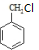 ,甲苯在光照条件与氯气发生取代生成氯甲苯,据此分析解答.
,甲苯在光照条件与氯气发生取代生成氯甲苯,据此分析解答.
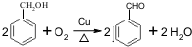
解答 解:(1)乙烯与溴水加成生成1,2-二溴乙烷,1,2-二溴乙烷难溶于水,密度大于水,乙烯通入到Br2水中,现象是溴水褪色,溶液分为两层且上层、下层均无色,反应的方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:溴水褪色,溶液分为两层且上层、下层均无色;CH2=CH2+Br2→CH2BrCH2Br;
(2)根据各物质的转化关系,由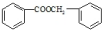 的结构及B生成C,C生成D可知,B为
的结构及B生成C,C生成D可知,B为 ,D为
,D为 ,所以C为
,所以C为 ,A的化学式为C7H7Cl,所以A为
,A的化学式为C7H7Cl,所以A为 ,甲苯在光照条件与氯气发生取代生成氯甲苯,
,甲苯在光照条件与氯气发生取代生成氯甲苯,
①C为 ,官能团名称是醛基,C发生氧化反应生成D,
,官能团名称是醛基,C发生氧化反应生成D,
故答案为:醛基;氧化反应;
②B-C的化学方程式为 ,
,
故答案为: ;
;
③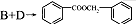 的化学方程式为
的化学方程式为  ,
,
故答案为: ;
;
④A为 ,则含有苯环的A的同分异构体还有苯环上连有-CH3和-Cl,有邻间对三种,
,则含有苯环的A的同分异构体还有苯环上连有-CH3和-Cl,有邻间对三种,
故答案为:3.
点评 本题考查有机物结构和性质及有机物推断,为高频考点,明确官能团及其性质关系是解本题关键,(2)中根据甲苯和苯甲酸苯甲酯结构简式采用正逆结合的方法进行推断,知道常见有机物官能团性质、常见反应类型及反应条件,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用S制备H2SO4 | B. | 用CaCO3、Na2CO3、SiO2生产玻璃 | ||
| C. | 将海水中的MgSO4转变为金属Mg | D. | 用NO2生产HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cu与含2 mol H2SO4的浓硫酸加热反应,转移的电子数为 2 NA | |
| B. | 5.80g[2 CaSO4.H2O]中含有的H2O分子数为0.04NA(M(2 CaSO4.H2O)=290g.nol-1) | |
| C. | 0.1 mol BaO2与足量的CO2完全反应转移电子数目为0.1NA | |
| D. | 10 mL 5 mol•L-1(NH4)2CO3溶液中含有N原子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铝和氢氧化钠溶液共热 | |
| B. | 氯化铝溶液中滴入过量氢氧化钾溶液 | |
| C. | 明矾溶液中滴入过量氨水 | |
| D. | 物质的量浓度相同的硝酸铝溶液和氢氧化钠溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.
2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.| A. | 加强海底可燃冰的探测与开发研究 | |
| B. | 积极推广风能、水能和太阳能发电 | |
| C. | 在生产、流通、消费等领域中实行“减量化、再利用、资源化” | |
| D. | 将高能耗、高污染的企业迁至偏僻的农村地区,提高农民收入 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中阴阳离子的个数比都是1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com