
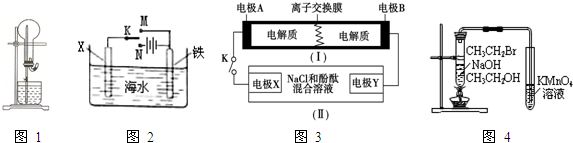
| A、图1的干燥烧瓶中盛有CO2,烧杯和滴管内盛有饱和NaHCO3溶液,挤压胶管的胶头会形成无色喷泉 |
| B、图2中若X为碳棒,开关K置于N处,铁极的反应:Fe-2e-═Fe2+ |
| C、图3中装置(Ⅰ)为一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红,则电极B发生了还原反应 |
| D、用图4验证溴乙烷发生消去反应生成烯烃 |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:

| A、P1>P2,n<3 |
| B、P1>P2,n>3 |
| C、P1<P2,n>3 |
| D、P1<P2,n<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种元素位于同一周期 |
| B、氢化物的稳定性H2Y>HZ |
| C、离子的氧化性aW3+>bX+ |
| D、原子半径Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液中:Cr2O72-、Fe2+、SO42-、K+ |
| B、无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4]2+ |
| C、加入过量氨水溶液仍然澄清的溶液中:Cu2+、Ag+、NO3-、NH4+ |
| D、能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
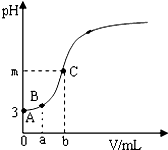 为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下:
为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下:| 编号 | V(CH3COOH)/mL | V(NaOH)/mL | |
| 初读数 | 末读数 | ||
| 1 | 25.00 | 0.00 | 25.00 |
| 2 | 25.00 | 1.00 | 26.02 |
| 3 | 25.00 | 1.10 | 26.08 |
| b |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的平衡浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A、2c1<c3 |
| B、a+b=92.4 |
| C、a1+a3<1 |
| D、p3>2p2=2p1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com